
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Комбинированные методы электрохимической отделочной обработки. ⇐ ПредыдущаяСтр 5 из 5 В группу этих методов включают главным образом электрохимическое хонингование и электрохимическое суперфиниширование. Электрохимическое хонингование — хонингование, в основе которого лежит удаление припуска не абразивным резанием, а электрохимическим растворениемповерхностного слоя отверстия заготовки. Используемый при электрохимическом хонинговании (рис. 3.14, а) электрод-инструмент (хон) мало отличается по конструкции от хона, используемого при хонинговании, реализуемого методом резания. Катодом при электрохимическом хонинговании служит корпус хонинговальной головки 3, имеющий меньший диаметр, чем диаметр обрабатываемого отверстия, на удвоенную величину межэлектродного зазора. В корпус головки врезаны непроводящие ток бруски 2, изготавливаемые чаще всего из дерева или пластмассы.
Рис. 3.14. Схемы электрохимического хонингования (а) и электрохимического суперфиниширования (б) Электрод-инструмент (хон) вращается с частотой nхон и совершает относительно заготовки возвратно-поступательное движение Электрохимическое хонингование используют для обработки точных цилиндрических отверстий. Диапазон размеров хонингуемых отверстий очень широк: по диаметру — от 5 до 800 мм, по длине — до 20 м. Используется этот метод также для подготовки поверхности под нанесение на неё гальванического покрытия.  Электрохимическим хонингованием обеспечивают примерно одинаковые параметры точности обработки и шероховатости поверхности, что и при обычном хонинговании: квалитеты точности размеров — 6…8, а шероховатость поверхности — Ra = 0,1…1,6 мкм. В то же время по сравнению с обычным хонингованием этот метод обладает рядом преимуществ. Производительность по съёму металла при реализации метода электрохимического хонингования в 4–8 раз выше и не зависит от твёрдости и прочности обрабатываемого материала, а обеспечиваемая точность достигается быстрее.Так как процесс ведётся при небольших давлениях брусков, электрохимическим хонингованием можно обрабатывать заготовки пониженной жёсткости. Экономический эффект электрохимического хонингования тем больше, чем выше припуски на обработку и чем хуже обрабатываемость материала методом резания. После электрохимического хонингования наблюдается «растравливание» поверхностного слоя металла по границам зёрен на глубину до 3…4 мкм. Поэтому обязательным этапом процесса является обработка выхаживанием с выключенным током при завершении процесса в течение нескольких секунд, что позволяет удалить растравленный слой абразивным способом. Электрохимическое суперфиниширование — суперфиниширование с использованием в качестве дополнительного воздействия на заготовку электрохимического растворения материала. Схема электрохимического суперфиниширования представлена на рис. 3.14, б.Абразивное воздействие на заготовку 1 при реализации данного метода обработки оказывает абразивный брусок 3. Брусок, изготовленный из алмазного порошка зернистостью M7…М10, прижимают к поверхности заготовки с силой 1,5…3,5 МПа и придают ему колебания (движение Dосц) с частотой 500…800 ходов в минуту. Одновременно с колебаниями брусок перемещается вдоль оси заготовки (движение Ds). Для осуществления электрохимического растворения поверхностного слоя заготовки с противоположной стороны от абразивного бруска установлен катод 2, а заготовка подключена к положительному полюсу источника питания. Между заготовкой и электродом-катодом устанавливается межэлектродный зазор, через который прокачивается электролит. Катод в процессе обработки остается неподвижным. В результате электролиза во впадинах и на вершинах микронеровностей обрабатываемой поверхности образуется пассивная плёнка. Эта плёнка удаляется абразивным бруском преимущественно на микровыступах поверхности заготовки. В результате совместного воздействия на заготовку электрохимического растворения и абразивного инструмента удаление припуска ускоряется по отношению к традиционному суперфинишированию, осуществляемому только абразивными брусками, при сохранении примерно таких же показателей точности размеров, шероховатости и качества поверхности. Одновременно со снижением шероховатости поверхности происходит незначительное уточнение формы в продольном и поперечном сечениях заготовки. Использование электрохимического суперфиниширования позволяет при большей производительности, чем при суперфинишированиирезанием, расширить перечень материалов, которые можно обрабатывать этим методом. Наибольшее повышение производительности обработки достигается при электрохимическом суперфинишировании вязких материалов. Электрохимическое абразивное полирование является комбинированным методом отделочной электрохимической обработки. Заготовку подвергают одновременно электрохимическому и механическому воздействиям. Физико-химическую основу данного метода составляют образование оксидных плёнок на микровыступах поверхности заготовки в процессе электрохимического растворения материала и последующее их удаление полировальником, перемещающимся в электролите относительно заготовки. Для интенсификации процесса удаления оксидных плёнок в электролит вводят абразивные микропорошки. Материал порошка определяется маркой материала заготовки. Чаще всего с этой целью используют оксид хрома Cr2O3. Электрохимическое абразивное полирование применяют для полирования заготовок, изготовленных из труднообрабатываемых сталей и сплавов. Такие материалы образуют на поверхности при электрохимическом полировании труднорастворимые оксидные плёнки, которые удаляются путём электрохимического растворения. В конце операции полирования источник питания отключают и выполняют несколько рабочих ходов полировальником без тока для предотвращения растравливания поверхностного слоя. При этом с обрабатываемой поверхности удаляется характерная для ЭХО тонкая плёнка, а сама поверхность приобретает металлический блеск. Шероховатость поверхности, получаемая электрохимическим абразивным полированием, также как и после электрохимического полирования, соответствует Ra = 0,025…0,04 мкм. Основные законы, описывающие процесс электролиза Физико-химические процессы, протекающие в технологической системе при электролизе, указывают на то, что этот процесс характеризуется превращением электрической энергии в энергию химических связей и сопровождается переносом вещества, электричества и тепла. Все эти «переносы» необходимо характеризовать количественно, устанавливая взаимосвязи между затратами введённой в систему энергии и полученными результатами. Основное соотношение, свойственное процессу электролиза, установлено и сформулировано английским учёным М. Фарадеем (первый закона Фарадея): масса вещества т (кг), восстановленного на катоде и окисленного на аноде, прямо пропорциональна количеству прошедшего через электролит электричества.Первый закон Фарадея выражается следующей формулой:
где kэх — электрохимический эквивалент вещества; q — количество электричества, Кл; I — сила тока в электролите, А; τо — основное время протекания процесса, с. Коэффициент kэх характеризует массу вещества анода в килограммах, растворённого (перемещённого с анода на катод) при токе 1 А за одну секунду. Числовые значения kэх для различных химических элементов приводятся в справочных материалах, например, работе [16]. Электрохимический эквивалент сплава
Каждый компонент сплава имеет свой электрохимический эквивалент, то есть свою скорость анодного растворения. В связи с этим в процессе обработки на поверхности заготовки возникают углубления и выступы, формирующие микропрофиль и шероховатость обработанной поверхности. В реальном процессе масса прореагировавшего при электролизе вещества меньше массы, вычисленной по закону Фарадея. Полезное использование тока характеризуют коэффициентом выхода по токуkвт:
где mф— фактическая масса вещества, прореагировавшего в процессе электролиза. Значение kвт варьируется в широких пределах и зависит от состава электролита, концентрации загрязнений электролита продуктами реакций, температуры электролита, плотности тока и других параметров процесса. Так, для электрохимического золочения (покрытие поверхности золотом) kвт достигает 90 %, хромирования (покрытие хромом) — 8…12 %, никелирования (покрытие никелем) — 90…95 %, кадмирования (покрытие кадмием) — 85…95 %. Второй закон Фарадея устанавливает зависимость электрохимического эквивалента kэхот атомной массы вещества А и его валентности z и формулируется следующим образом: электрохимический эквивалент вещества пропорционален его атомной массе и обратно пропорционален его валентности. Отношение атомной массы вещества к его валентности z называется химическим эквивалентом вещества: kх = А/z. (3.6) Применение формулы (3.6) к математической формулировке второго закона Фарадея позволяет сформулировать его следующим образом: электрохимические эквиваленты веществ пропорциональны их собственным химическим эквивалентам.
где Из равенства (3.7) следует, что отношение величины электрохимического эквивалента вещества к величине его химического эквивалента есть величина постоянная, имеющая для всех веществ одно и то же установленное значение:
Величина обратная этому значению, равная 96500 (Кл/моль), получила название постоянная Фарадея (F). Постоянная Фарадея показывает, что для выделения на электродах одного моля вещества нужно пропустить через электролит количество электричества равное 96500 Кл. Таким образом, второй закон Фарадея представляется формулой:
Подстановкой полученного выражения для kэх в первый закон Фарадея оба закона записываются следующей формулой:
Формула (3.9) показывает, что в результате прохождения через два различных электролита токов одинаковой силы в течение одного и того же промежутка времени из обоих электролитов выделяются количества веществ, относящиеся между собой как химические эквиваленты таковых. Так как kx = A/z, то можно представить формулу (3.3) для определения массы прореагировавшего на электродах вещества в следующем виде
Таким образом, основная количественная технико-экономическая характеристика процесса электрохимической обработки заготовок, характеризующая массу растворённого на аноде или осаждённого на катоде вещества и определяемая в соответствии с законами Фарадея по формуле (3.10), прямо пропорциональна его атомной массе, силе тока, времени электролиза и обратно пропорциональна валентности вещества.
[1] Перечни электрохимических методов обработки групп ЭХРО и ЭХОО дополнены комбинированными методами обработки, при реализации которых основным из нескольких энергетических воздействий на заготовку является электролиз. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 459. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

 . Заготовка устанавливается в ванне с электролитом 4 либо электролит прокачивают через межэлектродный промежуток между хоном и заготовкой. Съём металла с обрабатываемой поверхности происходит за счёт электрохимического растворения материала и удаления образующихся продуктов абразивным воздействием брусков хона. Чтобы это удаление было более эффективным, в электролит добавляют абразивный порошок.
. Заготовка устанавливается в ванне с электролитом 4 либо электролит прокачивают через межэлектродный промежуток между хоном и заготовкой. Съём металла с обрабатываемой поверхности происходит за счёт электрохимического растворения материала и удаления образующихся продуктов абразивным воздействием брусков хона. Чтобы это удаление было более эффективным, в электролит добавляют абразивный порошок. , (3.3)
, (3.3)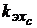 можно найти через электрохимические эквиваленты входящих в него компонентов
можно найти через электрохимические эквиваленты входящих в него компонентов  и их массовые доли mi в сплаве по формуле
и их массовые доли mi в сплаве по формуле . (3.4)
. (3.4) , (3.5)
, (3.5) или
или 
 , (3.7)
, (3.7)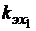 ,
,  ,
,  , …,
, …,  — электрохимические эквиваленты веществ;
— электрохимические эквиваленты веществ;  ,
,  ,
,  , …,
, …,  — химические эквиваленты тех же веществ.
— химические эквиваленты тех же веществ. = 1,036 × 10-5.
= 1,036 × 10-5. . (3.8)
. (3.8) . (3.9)
. (3.9)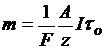 . (3.10)
. (3.10)