
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Нарушение гомеостаза внутриклеточного кальцияРоль кальция, как регулятора физиологических процессов, протекающих в клетке, хорошо известна. Нарушение внутриклеточного гомеостаза этого иона, сопровождающееся существенным повышением его концентрации в цитоплазме клетки, лежит, как полагают, в основе механизма клеточной гибели при целом ряде патологических состояний таких как ишемия, аутоиммунные процессы и т.д. Цитотоксическое действие самых разных токсикантов (цианидов, четыреххлористого углерода, свинца, метилртути, хлордекона, оловоорганических соединений, алкилирующих агентов, диоксина и т.д.) также полагают, хотя бы отчасти, связано с повышением уровня кальция внутри клеток. В норме низкая концентрация кальция в цитоплазме поддерживается механизмами его активного транспорта через биомембраны и системой его компартментализации (накопление в клеточных органеллах) (рисунок 5).
Рисунок 5. Схема регуляции содержания ионов кальция в цитоплазме. Обычно поступление Са2+ в клетку по градиенту концентрации уравновешивается его активным выведением, осуществляемым при участии Са2+-транспортной АТФазы в печени и эритроцитах и Na+/Ca2+ обменом в возбудимых тканях. Кроме того, уровень кальция регулируется его секвенированием в клеточных органелдах (ядре, митохондриях, эндоплазматическом ретикулуме), а также связыванием внутриклеточными белками. Нарушение механизмов поддержания гомеостаза внутриклеточного кальция, как это видно из представленной схемы обмена иона, может стать следствием: - повреждения биологических мембран и усиления их проницаемости для ионов; - нарушения биоэнергетики клетки, приводящие к истощению запасов макроэрогов;  - изменения функционального состояния белковых комплексов (в том числе путем действия на соответствующие рецепторы), образующих каналы для Са2+. Все эти механизмы могут приводить к усилению инфлюкса кальция из внеклеточной жидкости и его высвобождению из депо в цитоплазму клетки. Примеры веществ, повреждающих механизмы поддержания гомеостаза кальция внутри клеток, представлены в таблице 2. Таблица 2. Некоторые вещества, нарушающие распределение кальция внутри клетки
Цитотоксический эффект в результате стойкого повышения содержания кальция в цитоплазме в настоящее время связывают с развивающимся при этом повреждением целостности цитоскелета и неконтролируемой активацией катаболических энзимов (фосфолипаз, протеаз, эндонуклеаз). Повреждение цитоскелета Цитоплазма клетки помимо цитозоля и клеточных органелл, как правило, содержит еще и нитевидные белковые структуры, которые в массе формируют клеточный скелет. Это образование выполняет не только стабилизирующую и структурирующую, но и другие функции, среди которых обеспечение клеточного деления, внутриклеточный транспорт, секреция, обмен рецепторных белков, регуляция клеточной подвижности и формы. Белки цитоскелета эпителиальных клеток формируют филаменты кератина, в мышечных клетках - десмин или волокна актина и миозина, в соединительнотканных клетках - виментин, в эритроцитах - спектрин, в нервных и глиальных клетках - нейро- и глиофиламенты. Важную роль в физиологии клеток играют микротрубочки, образованные молекулами тубулина, организованные в характерные нитевидные структуры. Они принимают участие в формировании митотического веретена делящихся клеток. Велика роль структур, формирующих цитоскелет в нервных клетках. Здесь микрофиламенты и микротрубочки принимают участие в монтаже системы антероградного и ретроградного аксонального транспорта биологически активных веществ. Как известно белки синтезируются в перикарионе нейрона, а затем транспортируются с помощью этой системы на периферию клетки (в область синаптических контактов). Транспорт по аксону необходим и для обеспечения функций аксональных мембран: оборот глобулярных протеинов в мембране аксонов, выполняющих функции ионных каналов (см. выше). Состояние Швановских клеток также контролируется трофическими веществами, переносимыми с аксональным током. С аксональным током перемещается весь набор энзимов, нейромедиаторов и их предшественников, необходимых для обеспечения синаптической передачи нервных импульсов. При действии разнообразных веществ на изолированные клетки (культура ткани) выявляется отчетливое изменение формы их поверхности: появляются выпячивания цитоплазмы, называемые пузырьками (blebs). Такое "пузырение" (или вскипание - blebbing) клеточной мембраны - один из ранних и надежных признаков разрушения сети цитоскелета. Вещества, нарушающие гомеостаз внутриклеточного кальция, инициируют "вскипание" мембраны. Механизм феномена объясняют следующим образом. Кальций вовлечен в процесс поддержания структуры цитоскелета как непосредственно, так и через ряд Са2+-связывающих протеинов и Са2+-зависимых энзимов. Особенно значим уровень Са2+ в цитоплазме для образования ассоциации белков цитоскелета с белками плазматической мембраны и взаимодействия различных элементов цитоскелета. Стойкое увеличение концентрации кальция в цитозоле по-видимому вызывает отщепление актина микрофиламентов от
Рисунок 6. Са2+-зависимые механизмы повреждения цитоскелета клеток, обработанных хинонами Белки цитоскелета повреждаются не только в результате повышения содержания Са2+ в цитоплазме, но и в результате воздействия токсикантов с иными механизмами токсического действия. Так, непосредственно взаимодействуют с белками цитохалазины, фаллоидин (один из токсинов бледной поганки), а также колхицин (рисунок 7), алкалоиды барвинка (винбластин, винкристин).
Рисунок 7. Структура колхицина Действие веществ на тубулин митотического веретена делящихся клеток приводит к нарушению пролиферации последних (особенно клеток системы крови). Колхицин и алкалоиды барвинка в эксперименте, разрушая цитоскелет аксонов нервных клеток, существенно нарушают аксональный ток. Вероятно, аналогичные эффекты могут развиваться и при повреждении цитоскелета веществами, нарушающими внутриклеточный гомеостаз кальция. Активация фосфолипаз Фосфолипазы катализируют гидролиз фосфолипидов, входящих в состав клеточных мембран. Эти энзимы широко представлены в различных клетках. Особое внимание исследователи уделяют фосфолипазам А2 - группе липаз, основная функция которых состоит в удалении из мембраны поврежденных фосфолипидов, путем высвобождения жирных кислот, подвергшихся пероксидации. Фосфолипазы А2 являются Ca2+- и кальмодулин-зависимыми энзимами, и, следовательно, чувствительными к повышению кальция в цитоплазме. Стимуляция фосфолипазы кальцием приводит к усилению разрушения фосфолипидов мембран и повреждению клеток. Повышение содержания кальция в цитоплазме, активацию фосфолипазы, ускорение оборота фосфолипидов с последующей гибелью гепатоцитов регистрировали при токсическом поражении печени четыреххлористым углеродом. Аналогичные изменения наблюдали в миокардиоцитах и гепатоцитах, инкубируемых в условиях аноксии. Хлорпромазин, угнетающий активность фосфолипаз, защищает клетки от повреждающего действия циототоксикантов, нарушающих внутриклеточный гомеостаз кальция. Эти и другие данные подтверждают значение рассматриваемого механизма в развитии токсического повреждения клеток. Активация протеаз К числу протеаз, с оптимумом активности в области нейтральных значений рН, относятся: АТФ-зависимые, убиквитин-зависимые, Са2+_зависимые (кальпаины) протеазы. Кальпаины присутствуют практически во всех клетках млекопитающих. Они локализуются вне лизосом, в мембранных структурах в форме неактивного комплекса с ингибиторными протеинами (кальпастатины). Основные функции кальпаинов - репарация цитоскелета и клеточных мембран, разрушение рецепторных протеинов и их обновление, активация некоторых энзимов, участие в процессах митоза. Идентифицированы две изоформы энзимов - с высоким и низким сродством к кальцию, обе активируемые этим ионом. В эксперименте показано, что стойкая, неуправляемая активация кальпаинов кальцием приводит к повреждению микрофиламентов цитоскелета тромбоцитов, клеточных мембран эритроцитов, гибели клеток печени, миокардиоцитов и т.д. Активация эндонуклеаз При завершении клеткой жизненного цикла активируется процесс "программированной" физиологической клеточной гибели - апоптоз. На ранних этапах в апаптотической клетке проявляются морфологические изменения: "вскипание" клеточной и ядерной мембран, конденсация хроматина. Самым надежным маркером развивающегося процесса является активация эндонуклеаз, энзимов, расщепляющих хроматин на фрагменты - олигонуклеосомы. Активация эндонуклеаз отмечается при гибели тимоцитов и лимфоцитов в облученном организме. Установлено, что кальций участвует в активации эндонуклеаз. Вызванная глюкокортикоидами фрагментация ДНК тимоцитов и гибель этих клеток связаны со стойким повышением содержания Са2+ в цитоплазме. Одним из постоянных проявлений отравления экспериментальных животных диоксином является атрофия тимуса. Установлено, что при этом в тимоцитах значительно активируется процесс фрагментации ДНК, причем периоду разрушения хроматина предшествует период повышения концентрации кальция в цитоплазме. Возможно, что механизм цитотоксичности ТХДД хотя бы отчасти связан с кальциевой активацией эндонуклеаз. Активация эндонуклеаз может быть причиной гибели клеток печени, миокарда, почек при отравлениях многими химическими веществами. |
||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 381. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

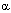 -актинина, белка, служащего промежуточным звеном, связывающим микрофиламенты цитосклета с белками плазматической мембраны. Кроме того Са2+ активирует протеазы (см. ниже), которые могут расщеплять актин-связывающие белки, разрушая тем самым места прикрепления филаментов цитоскелета к клеточной мембране. Отщепление цитоскелета от мембраны приводит к ослаблению фиксации последней и её "вскипанию", что и наблюдается при действии на клетки различных токсикантов (рисунок 6). Вещества, связывающие внутриклеточный кальций, и ингибиторы Са2+-зависимых протеаз препятствуют "вскипанию" плазматической мембраны клеток, обработанных токсикантами. Другой механизм изменения конфигурации плазматической мембраны под влиянием избыточной концентрации кальция, может состоять в истощении внутриклеточных запасов макроэргов.
-актинина, белка, служащего промежуточным звеном, связывающим микрофиламенты цитосклета с белками плазматической мембраны. Кроме того Са2+ активирует протеазы (см. ниже), которые могут расщеплять актин-связывающие белки, разрушая тем самым места прикрепления филаментов цитоскелета к клеточной мембране. Отщепление цитоскелета от мембраны приводит к ослаблению фиксации последней и её "вскипанию", что и наблюдается при действии на клетки различных токсикантов (рисунок 6). Вещества, связывающие внутриклеточный кальций, и ингибиторы Са2+-зависимых протеаз препятствуют "вскипанию" плазматической мембраны клеток, обработанных токсикантами. Другой механизм изменения конфигурации плазматической мембраны под влиянием избыточной концентрации кальция, может состоять в истощении внутриклеточных запасов макроэргов.
