
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
ОПРЕДЕЛЕНИЕ МАССЫ КАЛЬЦИЯ(II) В РАСТВОРЕЦЕЛЬ РАБОТЫ:научиться применять метод гомогенного осаждения (метод возникающих реагентов) для определения массы вещества в растворе.
ЦЕЛЕВЫЕ ЗАДАЧИ: 1. Доведение тигля до постоянной массы. 2. Расчет массы кальция (II), необходимой для выполнения анализа с допустимой погрешностью. 3. Получение осаждаемой формы в виде мелкокристаллического осадка кальция оксалата методом гомогенного осаждения. «Созревание» осадка. 4. Отделение осадка кальция оксалата от маточного раствора фильтрованием. 5. Получение гравиметрической формы кальция сульфата путем прокаливания осадка кальция оксалата, превращение продуктов термического разложения последнего в кальция сульфат и прокаливания полученного осадка до постоянной массы. 6. Промывание осадка кальция оксалата. 7. Расчет массы кальция (II) в растворе. 8. Статистическая обработка результатов параллельных определений массы кальция (II) в растворе.
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ: Посуда (в расчете на 1 студента): 1. Бюретка вместимостью 25 мл 1 шт. 2. Тигель фарфоровый с крышкой 1 шт. 3. Стакан химический термостойкий вместимостью 400 мл 1 шт. 4. Воронка для фильтрования 1 шт. 5. Палочка стеклянная с резиновым наконечником 1 шт. 6. Палочка стеклянная с острым концом 1 шт. 7. Промывалка 1 шт. 8. Пипетка с резиновым колпачком 1 шт. 9. Полумикропробирка 1 шт. 10. Цилиндр мерный вместимостью 100 или 200 мл 3 шт.* 11. Эксикатор большой 1 шт.* 12. Эксикатор малый 3 шт.* * – в расчете на 15 человек Реактивы (квалификация «ч. д. а.» или «х. ч.»): 1. Соли кальция: нитрат или хлорид;  2. Кислота серная, 4 моль/л раствор; 3. Кислота соляная, 6 моль/л (1:1)раствор; 4. Аммиак, 10%-ный раствор; 5. Аммония оксалат, 5%-ный раствор; 6. Метиловый оранжевый, 0,1%-ный раствор. Приборы (в расчете на 15 человек): 1. Баня водяная 4 шт. 2. Баня песчаная 1 шт. 3. Печь муфельная 1 шт. 4. Шкаф сушильный 1 шт. 5. Весы аналитические с разновесом 5 шт. 6. Горелка газовая 15 шт. Другое необходимое оборудование: 1. Штатив с набором лапок и колец 15 шт. 2. Щипцы тигельные 5 шт. 3. Щипцы муфельные 1 шт. 4. Сетка асбестовая 15 шт. 5. Треугольник фарфоровый 15 шт. 6. Фильтр беззольный «синяя лента» 15 шт. 7. Средства моющие, 8. Ерши для мытья посуды, 9. Спички, 10. Полотенце, мыло.
Методика определения массы кальция(II) в растворе Методом гомогенного осаждения Сущность методики Катион кальция (II) осаждают в виде мелкокристаллического осадка моногидрата кальция оксалата Ca2+ + C2O42– + H2O = CaC2O4 · H2O(т) Методом гомогенного осаждения (метод возникающих реагентов), позволяющим вести осаждение при минимальном пересыщении раствора относительно осаждаемой формы. Согласно методике осадитель – аммония оксалат – вводят в сильнокислый раствор соли кальция, в котором осадок кальция оксалата не образуется, благодаря протеканию конкурирующей осаждению реакции протонизации оксалат-иона: C2O42– + H+ = HC2O4– Далее к прозрачному раствору медленно, по каплям добавляют раствор аммиака до pH ~ 4 (индикатор метиловый оранжевый). При этом концентрация оксалат-иона повышается и происходит осаждение моногидрата кальция оксалата – осаждаемой формы. Для понижения растворимости осадка в кислой среде вводят большой избыток осадителя. Гомогенное осаждение обычно приводит к получению чистого крупнокристаллического осадка. Однако, в данном случае, несмотря на оптимальные условия осаждения кальция, оксалат образует осадок с довольно мелкими кристаллами. В связи с этим после осаждения раствор с осадком оставляют на некоторое время в покое с целью укрупнения и совершенствования кристаллов осаждаемой формы («созревание» осадка). Для отделения полученного мелкокристаллического осадка кальция оксалата от маточного раствора используют плотный беззольный бумажный фильтр «синяя лента». Из-за довольно заметной растворимости кальция оксалата (K Из одной и той же осаждаемой формы-моногидрата кальция оксалата можно получить несколько гравиметрических форм (ГФ), в различной степени пригодных для целей анализа (см. Справочник Лурье, табл. 5): CaC2O4 • x H2O
450-550°С 200°C 550-900°C
CaO (ГФ4) ~900°C CaSO4 (ГФ5) Первые две гравиметрические формы (ГФ1 и ГФ2) трудно получить с точным стехиометрическим составом, кроме того эти формы – гигроскопичны. Поэтому они редко используются на практике. ГФ3 (кальция карбонат) обладает некоторыми преимуществами перед и ГФ4 (кальция оксидом): эта форма в отличие от последней не гигроскопична и имеет меньший гравиметрический фактор (0,004 против 0,7147). Однако, для ее получения необходимо поддерживать температуру в очень узких пределах (450-500ºС), что на газовой горелке или муфельной печи трудно осуществить. Поэтому обычно при прокаливании получается смесь кальция карбоната и кальция оксида. В связи с этим более надежным является получение в качестве ГФ кальция оксида путем прокаливания осадка при температуре выше 900ºС, при которой происходит практически полное превращение кальция карбоната в кальция оксид. В настоящей работе в качестве ГФ применяется кальция сульфат (ГФ5). Преимуществом использования этой формы перед кальция оксидом является меньший гравиметрический фактор (0,2944) и устойчивость к углекислому газу. К сожалению, кальция сульфат, так же как и кальция оксид, гигроскопичен. Поэтому при измерении массы кальция сульфата требуется принимать определенные меры предосторожности. Для получения ГФ5 продукты термического разложения кальция оксалата (смесь кальция карбоната и кальция оксида) обрабатывают серной кислотой: CaCO3 + H2SO4 = CaSO4(Т) + CO2(Г) + H2O CaO + H2SO4 = CaSO4(Т) + H2O Далее полученный осадок высушивают и прокаливают до постоянной массы при температуре около 900ºС. 2. Предварительные расчеты. Расчет массы кальция, необходимой для выполнения анализа с допустимой погрешностью ± 0,2% Чтобы процентная погрешность определения не превышала ± 0,2 %, масса гравиметрической формы (ГФ) должна быть не менее 0.1 г. Для кристаллических осадков оптимальная масса ГФ – 0,1 + 0,5 г. В данном случае она принята за 0,3 г. Тогда масса кальция, подлежащая анализу, должна быть равна примерно 0,1 г: m(Ca) = m(CaSO4) • Ғ = 0,3 • 0,2944 ≈ 0,1 [г] |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 686. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
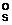 = 2,3 ·10–9) осадок отмывают от примесей разбавленным раствором аммония оксалата (летучий электролит, содержащий одноименный с осадком ион).
= 2,3 ·10–9) осадок отмывают от примесей разбавленным раствором аммония оксалата (летучий электролит, содержащий одноименный с осадком ион). 105-110°C
105-110°C

 CaCO3 (ГФ3) CaC2O4 (ГФ2) CaCO3, CaO
CaCO3 (ГФ3) CaC2O4 (ГФ2) CaCO3, CaO 900-1200°C +H2SO4 CaSO4 • x H2O
900-1200°C +H2SO4 CaSO4 • x H2O