
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
В растворимых солях железа(II) или железа(III)1. Сущность методики Определение железа в растворимых солях железа(II) или железа(III) основано на предварительном окислении железа(II) до железа(III), осаждении железа(III) гидроксида (осаждаемая форма), прокаливании и взвешивании железа(III) оксида (гравиметрическая форма). Ион железа(III) осаждают в виде практически нерастворимого (KS = 6,3 • 10–38) аморфного осадка железа(III) гидроксида действием аммиака: Fe3+ +3NH3 • H2O = Fe(OH)3(T) + 3NH4+ Вместо аммиака для осаждения не следует применять едкие щелочи, так как осадок железа(III) гидроксида адсорбирует заметные количества щелочей, которые плохо удаляются при промывании осадка. При осаждении раствором аммиака необходимо, чтобы железо в растворе было в окисленной форме. Ион железа(II) количественно не осаждается аммиаком, поскольку наряду с образованием труднорастворимого гидроксида образуются также растворимые аминокомплексы железа(II). В связи с этим после растворения навески анализируемого образца в воде железо(II) окисляют до железа(III) действием концентрированного раствора азотной кислоты (или раствора пероксида водорода) при нагревании: 3Fe2+ + NO–3 + 4H+ = 3Fe3+ + NO(Г) + 2H2O Обработке азотной кислотой подлежат как соли железа(II), так и соли железа(III). Так как в последних, в результате попадания органической пыли из воздуха, может происходить частичное восстановление железа(III) до железа(II). Следует отметить, что азотная кислота служит не только для окисления железа(II), но и для предотвращения гидролиза солей железа, который протекает с образованием труднорастворимых основных солей этого элемента: Fe3+ + H2O + Cl – = Fe(OH)2Cl(Т) + 2H+ Если железо(II) не полностью окислилось до железа (III), то при действии аммиака вместо красно-коричневого осадка железа (III) гидроксида образуется черный осадок железа (II) и железа (III) гидроксида неопределенного состава, очень устойчивый при прокаливании. Поэтому, если получается черный осадок, то его растворяют в разбавленном растворе азотной кислоты при нагревании и повторяют осаждение аммиаком.  Осаждаемая форма – железа (III) гидроксид, в силу своей природы образует объемистые аморфные осадки, для которых характерна ярко выраженная адсорбционная способность. Количество адсорбированных примесей зависит от размера поверхности осадка. Поэтому осаждение железа (III) гидроксида проводят в условиях, обеспечивающих получение хорошо скоагулированного компактного осадка с наименьшей поверхностью. По методу Тананаева осаждение проводят при большом пересыщении раствора относительно осаждаемой формы в следующих условиях: а) осаждение ведут из концентрированного раствора концентрированным раствором осадителя; б) раствор осадителя добавляют быстро; в) для предотвращения образования коллоидных частиц осаждение ведут из горячего раствора, желательно, в присутствии электролита-коагулянта. После осаждения раствор с аморфным осадком немедленно разбавляют горячей водой (для уменьшения загрязнения осадка адсорбированными примесями) и сразу же фильтруют. При фильтровании аморфного осадка используют неплотный беззольный фильтр «красная лента». Осадок можно промывать горячей водой (при этом потери вещества, вследствие очень малой растворимости осадка, ничтожны, а использование горячей воды предупреждает пептизацию осадка). Однако, для более эффективного предупреждения пептизации рекомендуется промывание осадка проводить горячим разбавленным раствором электролита-коагулянта. В качестве последнего следует использовать аммония нитрат, но не аммония хлорид, так как использование аммония хлорида может привести к потерям вещества в результате улетучивания железа(III) хлорида при последующем прокаливании осадка. Гравиметрическая форма – железа(III) оксид, получается путем прокаливания осаждаемой формы при температуре 800-900°С: 2Fe(OH)3 = Fe2O3 + 3H2O(Г) Прокаливание при более высокой температуре проводить не следует во избежание частичного термического разложения железа(III) оксида: 6Fe2O3 = 4Fe3O4 + O2(Г) Газы, образующиеся при озолении фильтра, а также продукты неполного сгорания светильного газа в горелке, могут восстанавливать железо (III) оксид до железа (II) и железа (III) оксида, до железа (II) оксида и даже до металлического железа. Чтобы избежать этого, необходимо при прокаливании обеспечить к осадку достаточный доступ воздуха. Массовую долю (в процентах) железа в образце рассчитывают по массам гравиметрической формы и взятой навески образца. Основные источники погрешностей при определении железа обусловлены содержанием в растворе аммиака кремневой кислоты, которая соосаждается с железа (III) гидроксидом. Поэтому нельзя пользоваться раствором аммиака, который долго хранился в стеклянной посуде. Если железо(III) гидроксид осаждается из раствора, содержащего хлориды, то недостаточно промытый осадок может содержать значительное количество соосажденного железа (III) хлорида, которое улетучивается при прокаливании осадка. Примесь кремниевой кислоты дает завышенные результаты, а примесь хлорида железа(III) и превращение оксида железа (III) в железа(II) и железа(III) оксид дает заниженное содержание железа.
Предварительные расчеты Расчет массы навески Оптимальную массу навески образца рассчитывают по формуле:
где m(г.ф.) – оптимальная масса гравиметрической формы, которую хотят получить, г; W%(X) – примерное значение массовой доли (в процентах) определяемого компонента в образце; Ғ – гравиметрический фактор. Примерное значение массовой доли (в процентах) железа в образце указывает преподаватель. Гравиметрический фактор для определения железа по массе железа(III) оксида находят по Справочнику Лурье, табл. 5. Массу навески рассчитывают приблизительно с точностью до второй значащей цифры. 2.2. Расчет объема раствора осадителя В качестве осадителя иона железа(III) используют 10%-ный водный раствор аммиака. 1) Массовая доля (в процентах) железа в образце рассчитывается по формуле:
Из этого выражения следует, что
где m(Fe) – масса железа в навеске образца, г ; m(навески) – масса навески образца, г ; W%(Fe) – примерная массовая для железа в образце, %.
2) Для расчета массы осадителя m(NH3 • H2O), необходимой для осаждения иона железа(III), составляют пропорцию, исходя из уравнения реакции, согласно которой на 1 моль иона железа(III) затрачивается 3 моля осадителя.
m(Fe3+) – m(NH3 • H2O)
где M(Fe3+) и M(NH3 • H2O) – молярные массы иона железа(III) и осадителя соответственно, г/моль.
3) Для определения объема раствора осадителя «V» необходимо знать его плотность «ρ» (см. Справочник Лурье, табл. 17). Тогда, учитывая, что массовая доля W%(NH3 • H2O) показывает число граммов осадителя, содержащееся в 100 г раствора, нетрудно вычислить объем раствора аммиака, в котором содержится m(NH3 • H2O) граммов осадителя.
, m(NH3 • H2O)г – V(NH3 • H2O) мл
4) Поскольку аммиак – летучий осадитель, рекомендуется двух или трехкратный избыток его по сравнению с рассчитанным стехиометрическим количеством. 5) Таким образом, формула для расчета объема раствора осадителя имеет вид:
Объем раствора осадителя рассчитывают приблизительно с точностью до второй значащей цифры.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 609. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
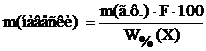 ,
,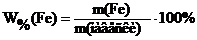
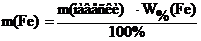 , г
, г M(Fe3+) – 3M(NH3 • H2O)
M(Fe3+) – 3M(NH3 • H2O)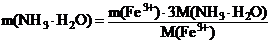 , [г]
, [г]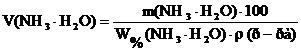

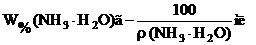
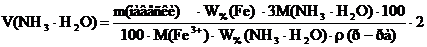 , [мл]
, [мл]