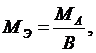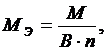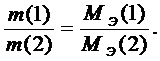Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЦИНКАСтр 1 из 10Следующая ⇒ Министерство образования и науки РФ Иркутский государственный технический университет
ХИМИЯ
Методические указания к выполнению лабораторных работ
Иркутск 2005
Химия. Методические указания к выполнению лабораторных работ. Составили: З.Н. Топшиноева, В.П. Зуева, А.Н. Волков, О.В. Лебедева. –Иркутск: 2005. - 34 с., ил.
Практикум по химии предназначен для студентов 1 курса, обучающихся по техническим направлениям и специальностям. Включает описание 11 лабораторных работ. Каждой лабораторной работе предшествует краткое теоретическое введение.
Библиогр. 5 назв. Рис. 1. Табл. 5.
Рецензент доцент кафедры химии Г.М. Белозерова
ОГЛАВЛЕНИЕ
Лабораторная работа 1 ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Все вещества делятся на простые и сложные. Сложные вещества подразделяются на четыре важнейших класса: оксиды, кислоты, основания, соли. Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. Оксиды разделяются на несолеобразующие (N2O, NO, SiO) и солеобразующие. Солеобразующие оксиды по химическим свойствам делятся на основные (Na2O, CaO, MgO), кислотные (SO2, SO3, P2O5, Mn2O7, CrO3) и амфотерные (ZnO, Al2O3, Cr2O3, PbO).  Оксиды взаимодействуют:
Получаются оксиды взаимодействием простых и сложных веществ с кислородом, а также разложением некоторых кислородсодержащих веществ при нагревании: 2Са + O2 = 2СаO 2ZnS + 3O2 = 2ZnO + 2SO2 Cu(OH)2 = CuO + H2O
Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка (H2SO4, HNO3, HCl). Кислоты взаимодействуют: 1. С основаниями с образованием соли и воды 2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O 2. С основными оксидами с образованием соли и воды 2HCl + ВаO = ВаCl2 + H2O 3. С солями с образованием новой соли и новой кислоты H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3 Одним из способов получения кислот является взаимодействие кислотного оксида с водой: P2O5 + 3H2O = 2H3PO4 Основания – сложные вещества, состоящие из атомов металла, связанных с одной или несколькими гидроксильными группами (NaOH, KOH, Cu(OH)2). Основания взаимодействуют: 1. С кислотами с образованием соли и воды 2NaOH + H2SO4 = Na2SO4 + 2H2O 2. С кислотными оксидами с образованием соли и воды 2KOH + CO2 = K2CO3 + H2O 3. С солями с образованием новой соли и нового основания NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl Растворимые в воде основания (щелочи) получают взаимодействием активных металлов или их оксидов с водой: 2Na + 2H2O = 2NaOH + H2↑ BaO + H2O = Ba(OH)2 Нерастворимые в воде основания получают реакцией обмена: Fe2(SO4)3 + 6KOH = 2Fe(OH)3↓ + 3K2SO4 Соли – это продукты замещения водорода в кислоте на металл или гидроксильных групп в основании на кислотный остаток. Соли бывают средние, кислые, основные. Средние соли (К2SO4, Na3PO4) – это продукты полного замещения водорода в кислоте на металл: H2SO4 + 2KOH = K2SO4 + 2H2O Кислые соли (Сa(HCO3)2, Nа2НРО4) – это продукты неполного замещения водорода в кислоте на металл: KOH + H2SO4 = KHSO4 + H2O Основные соли ((СuOH)2СO3, FeOHCl2) – это продукты неполного замещения гидроксильной группы в основании на кислотный остаток: Mg(ОН)2 + HCl = MgOHCl + Н2О
Выполнение работы Опыт 1. Получение и свойства основных оксидов (групповой) (Проводить в вытяжном шкафу!) Возьмите пинцетом кусочек магниевой стружки и внесите в пламя спиртовки. После воспламенения сожгите его над фарфоровой чашкой. Собранный в чашке оксид магния поместите в две пробирки. В одну прилейте 1-2 мл воды, хорошо взболтайте и добавьте 1-2 капли фенолфталеина. Объясните появление окраски. В другую пробирку добавьте 1-2 мл разбавленной серной кислоты и нагрейте на спиртовке до растворения осадка. Составьте уравнения реакций взаимодействия магния с кислородом, оксида магния с водой и серной кислотой. Какими свойствами, основными или кислотными, обладает оксид магния? Опыт 2. Получение и свойства кислотных оксидов (групповой) (Проводить в вытяжном шкафу!) Поместите в металлическую ложечку кусочек серы величиной с горошину и нагрейте на пламени спиртовки. Когда сера загорится, поднесите к ней влажную индикаторную бумажку. В какой цвет она окрашивается? О каких свойствах оксида серы (IV), основных или кислотных, свидетельствует окраска индикатора? Напишите уравнения реакций взаимодействия серы с кислородом, оксида серы (IV) с водой. Опыт 3. Взаимодействие амфотерных оксидов с кислотами и щелочами В две пробирки поместите немного оксида цинка и прилейте в одну пробирку соляной кислоты, а в другую – щелочи. Если осадок не растворяется, пробирку подогрейте. Напишите уравнения реакций взаимодействия оксида цинка с кислотой и щелочью. Опыт 4. Получение и свойства оснований Налейте в пробирку 1-2 мл раствора сульфата никеля и прибавьте столько же щелочи NaOH. Наблюдайте образование студенистого осадка. Отметьте его цвет. Содержимое пробирки поделите на две части. Испытайте растворимость осадков в кислоте и щелочи. Сделайте вывод о свойствах гидроксида никеля (II). Напишите уравнения реакций получения гидроксида никеля (II) и его растворения. Опыт 5. Получение основных солей К 1-2 мл раствора хлорида кобальта (II) добавьте концентрированный раствор щелочи до образования розового осадка гидроксида кобальта (II). К осадку прилейте по каплям раствор соляной кислоты. Наблюдайте образование синего осадка основной соли. Затем добавьте избыток кислоты до его растворения. Напишите уравнения реакций получения гидроксида кобальта (II), основной соли CoOHCl и растворения ее в избытке кислоты. Лабораторная работа 2 ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЦИНКА Эквивалент(Э) – это реальная или условная частица вещества, соответствующая одному иону водорода в кислотно-основных или ионообменных реакциях, или одному электрону в окислительно-восстановительных реакциях. Под реальной частицей понимают реально существующие соединения (NaOH, H2SO4, H2O), под условной – доли этих реальных частиц (1/2 H2SO4, ½ H2O).Единицей количества эквивалентов является моль. Моль эквивалентов – это количество вещества, содержащего 6,02×1023 эквивалентов. Масса одного моль эквивалентов называется молярной массойэквивалентов(МЭ)и выражаетсяв г/моль. Для расчета молярной массы эквивалентов можно использовать формулы:
1) для элемента где МА – молярная масса атомов данного элемента; В - валентность атома
2) для сложного вещества где М – молярная масса данного вещества; В - валентность функциональной группы; n – число функциональных групп в молекуле. Для кислот функциональной группой является ион водорода, для оснований – гидроксид-ион, для солей – ион металла. Например, Мэ(Al) = МA/В = 27/3 = 9 г/моль, Мэ(H2SO4) = М/В∙n = 98/1∙2 = 49 г/моль, Мэ(NaOH) = М/В∙n = 40/1∙1 = 40 г/моль, Мэ((Al2(SO4)3) = М/В∙n = 342/3∙2 = 57 г/моль. Эквивалент (Э) – безразмерная величина, состав которой выражают с помощью знаков и формул. Например, Э(NaOH) = NaOH, Э(H2SO4) = 1/2H2SO4. Число, обозначающее, какая доля от реальной частицы эквивалентна одному иону водорода или одному электрону, называется фактором эквивалентности (fэ). Фактор эквивалентности определяется по формуле: fэ = Mэ /M Например, fэ(Al) = 9/27 = 1/3, fэ (H2SO4) = 49/98 = 1/2, fэ(NaOH) = 40/40 = 1, fэ ((Al2(SO4)3) = 57/342 = 1/6.
Используя определение молярной массы эквивалента, можно сформулировать закон эквивалентов: массы участвующих в реакции веществ пропорциональны молярным массам их эквивалентов.
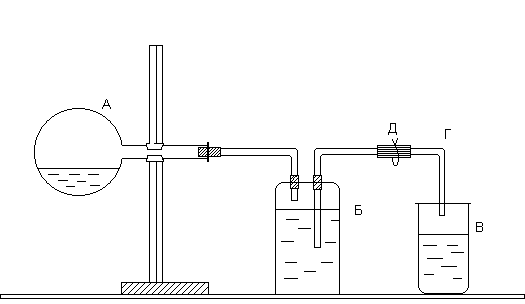
Выполнение работы Один из методов определения молярной массы эквивалентов металла основан на реакции растворения металла в избытке кислоты и измерении объема выделившегося водорода. По объему водорода вычисляют его массу, а затем молярную массу эквивалентов металла. Определение молярной массы эквивалентов металла производится в приборе, изображенном на рисунке. Прибор состоит из трех частей: колбы А, двугорлой склянки Вульфа Б и приемника В. Отверстия двугорлой склянки закрываются резиновыми пробками, через которые проходят стеклянные трубки: короткая, оканчивающаяся сразу под пробкой, и длинная, доходящая почти до дна склянки. Короткая стеклянная трубка соединяется резиновой трубкой с колбой А, а длинная - со стеклянной трубкой Г, опущенной в приемник В.
Работу следует выполнять в следующем порядке. Наполните водой двугорлую склянку. В колбу налейте 10-15 мл соляной кислоты. Закрепите колбу в горизонтальном положении. Получите у преподавателя навеску цинка и поместите ее в сухое горло колбы. Закройте колбу резиновой пробкой и проверьте герметичность прибора. Для этого откройте зажим Д и вдуйте воздух в прибор через стеклянную трубку Г. В приборе создается избыточное давление, вследствие чего вода из трубки Г вытекает. Когда давление внутри прибора станет равным атмосферному, вода из трубки перестанет течь. Закройте зажим Д. Если вода из трубки Г не уходит, прибор герметичен. Воду из приемника вылейте и поставьте его под трубку Г. Наклоните колбу так, чтобы навеска цинка упала в кислоту, и откройте зажим. Водород, выделившийся при взаимодействии металла с кислотой, вытесняет воду из склянки Б в приемник В. Когда весь металл растворится, дайте прибору остыть, не закрывая зажима. Осторожно выньте из приемника трубку Г (следите, чтобы из нее не вылилась вода), измерьте мерным цилиндром объем воды в приемнике. Этот объем равен объему водорода, выделившегося при взаимодействии металла с кислотой. Запишите показания барометра и термометра. Исходные данные и результаты расчетов занесите в табл. 1.
Таблица 1 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 641. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||