Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Патогенез заболевания и иммунитет⇐ ПредыдущаяСтр 38 из 38 Острые кандидозы слизистых оболочек и кандидный дисбактериоз возникают вскоре после лечения антибиотиками широкого спектра действия. Тяжелые и хронические формы кандидоза развиваются на фоне иммунодефицита. При этом на фоне только Т-клеточного иммунодефицита (при ВИЧ-инфекции и некоторых первичных иммунодефицитах) развиваются преимущественно поверхностные формы кандидоза: хронический кандидный стоматит, эзофагит, вагинит, распространенный кандидоз кожи и слизистых оболочек. Глубокий кандидоз с поражением кишечника, легких и почек развивается на фоне нейтропении при инвазии Candida со слизистых оболочек. Диссеминированные формы кандидоза с поражениями разных органов могут возникнуть и без нейтропении, как экзогенная инфекция при загрязнении грибами Candida (как правило, более редкими видами, а не С. albicans) систем переливания крови в стационаре, или игл и шприцев у инъекционных наркоманов. Факторы иммунитета при кандидозе хорошо изучены. Распознавание и захват клеток гриба осуществляется макрофагами и нейтрофилами при опсонизации факторами комплемента и антителами или непосредственно (только макрофагами) с помощью маннозо-связывающего рецептора. Секреторные антитела класса IgA препятствуют адгезии гриба к слизистым оболочкам. В уничтожении клеток Candida участвуют как окислительные, так и неокислительные механизмы. Регуляция иммунного ответа осуществляется Т-лимфоцитами хелперами обоих подклассов, Т-супрессорами, гамма/дельта клетками и естественными киллерами. Дефект любой из этих систем может приводить к хроническим формам поверхностного кандидоза, а выраженная недостаточность фагоцитоза - и к глубокому кандидозу. С. albicans имеет способности к иммуномодуляции и дисрегуляции иммунного ответа за счет динамической экспрессии маннановых и белковых антигенов. 
Лабораторная диагностика. В микробиологической диагностике кандидоза в настоящее время ориентируются на выделение его главного (более 80% всех случаев) возбудителя С. albicans. Простейшим методом является проростковая проба: способность С. albicans образовывать зачатки истинных гиф на среде с сывороткой в течение 3 ч. Разработаны тесты быстрой идентификации: хромогенные среды (С. albicans на них дает пигмент), быстрое определение антигенов и ферментов в течение часа и другие. Идентификация других видов ведется преимущественно по спектру усваиваемых сахаров. Для этого выпущены специальные тест-системы и панели для автоматических анализаторов.
Иммунологическая и молекулярная диагностика Серодиагностика кандидоза малоэффективна в связи с распространенным носительством грибов рода Candida. Используются тесты иммунопреципитации, иммуноферментные и латекс-агглютинация. Иммунологическая диагностика включает определение маннанового антигена в крови (латекс-агглютинация) при диссеминированном кандидозе. В последние годы в диагностике глубокого кандидоза используется также газожидкостная хроматография, определяющая компоненты клеточной стенки грибов D-маннозу и арабинитол. Полимеразная цепная реакция (ПЦР) используется только в диагностике глубоких форм кандидоза в связи с распространенным носительством Candida.
Лечение и профилактика. В настоящее время в лечении глубокого кандидоза применяются инъекционные полиеновые антибиотики (амфотерицин В), а также препараты из класса азолов (флуконазол, итраконазол, кетоконазол). К данным препаратам разные виды Candida чувствительны неодинаково. Есть виды, исходно устойчивые к флуконазолу (С. krusei, С. glabrata) и амфотерицину (С. lusitaniae). На фоне иммунодефицита при ВИЧ-инфекции развивается приобретенная устойчивость к флуконазолу у С. albicans. Нистатин и леворин плохо всасываются из кишечника, в связи с чем лечение ими глубоких и диссеминированных форм не имеет смысла. В последнее время разработаны новые малотоксичные липосомальные формы полиеновых антибиотиков для внутривенного введения - липосомальный амфотерицин В («амбизом»), липосомальный нистатин («ниотран»). Принципиально новым является препарат каспофунгин («кандикас»), подавляющий синтез глюкана клеточной стенки. Профилактическое лечение кандидоза проводится у больных с нейтропенией.
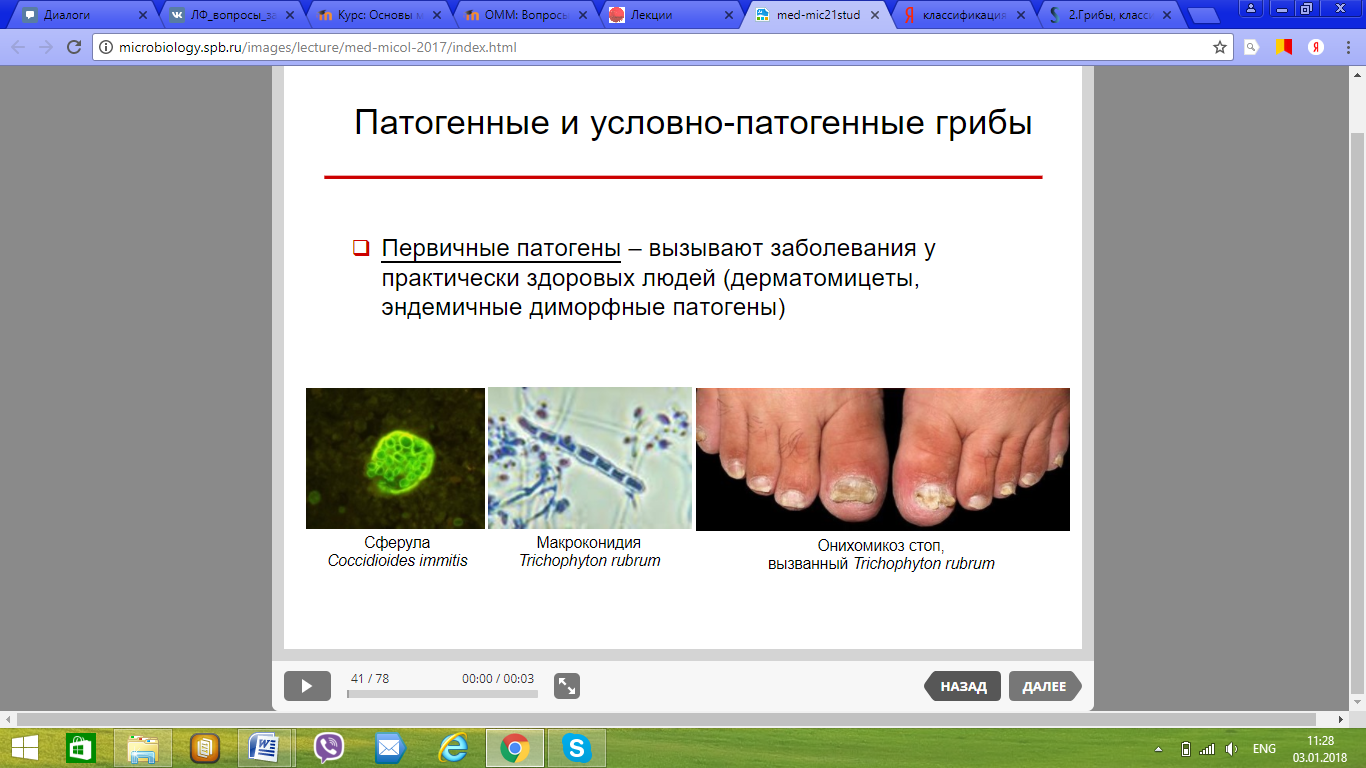
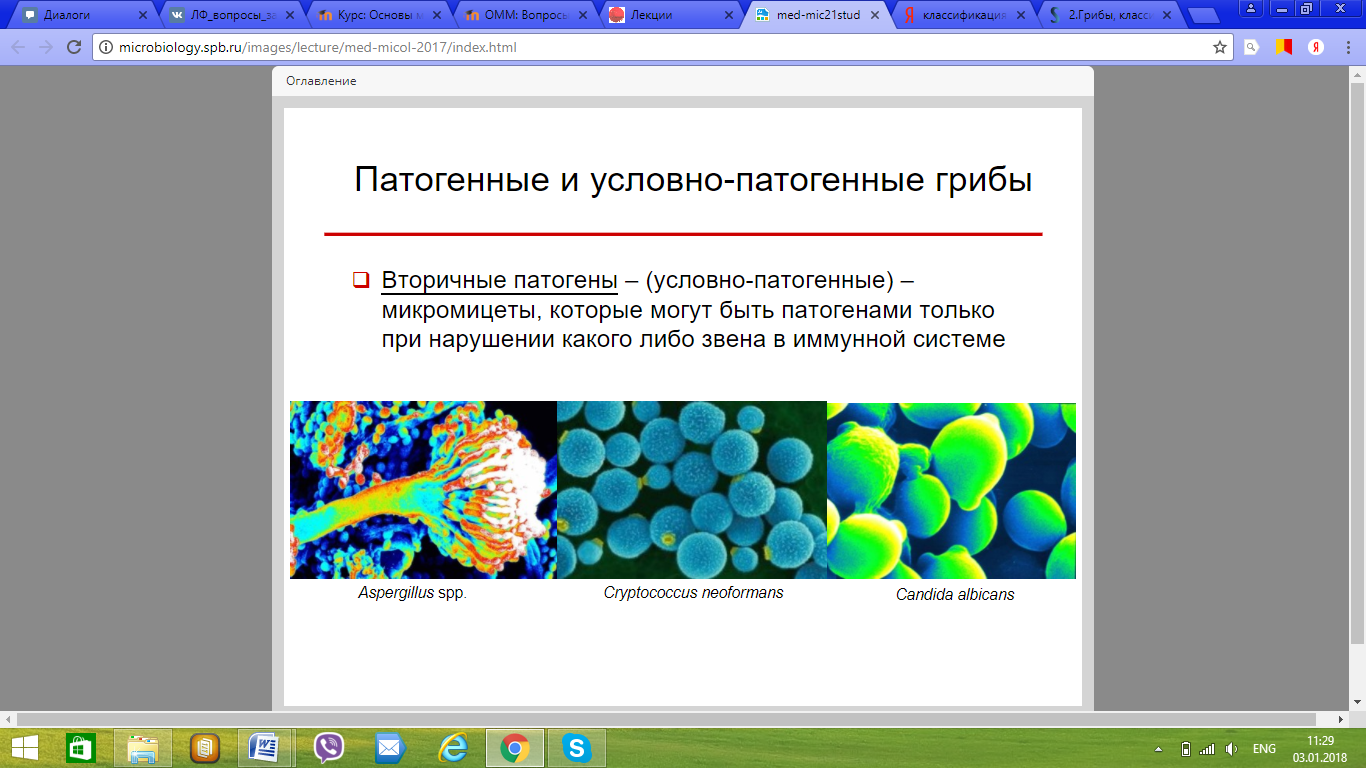
110. Патогенные и условно-патогенные грибы. Классификация грибов по группам патогенности.
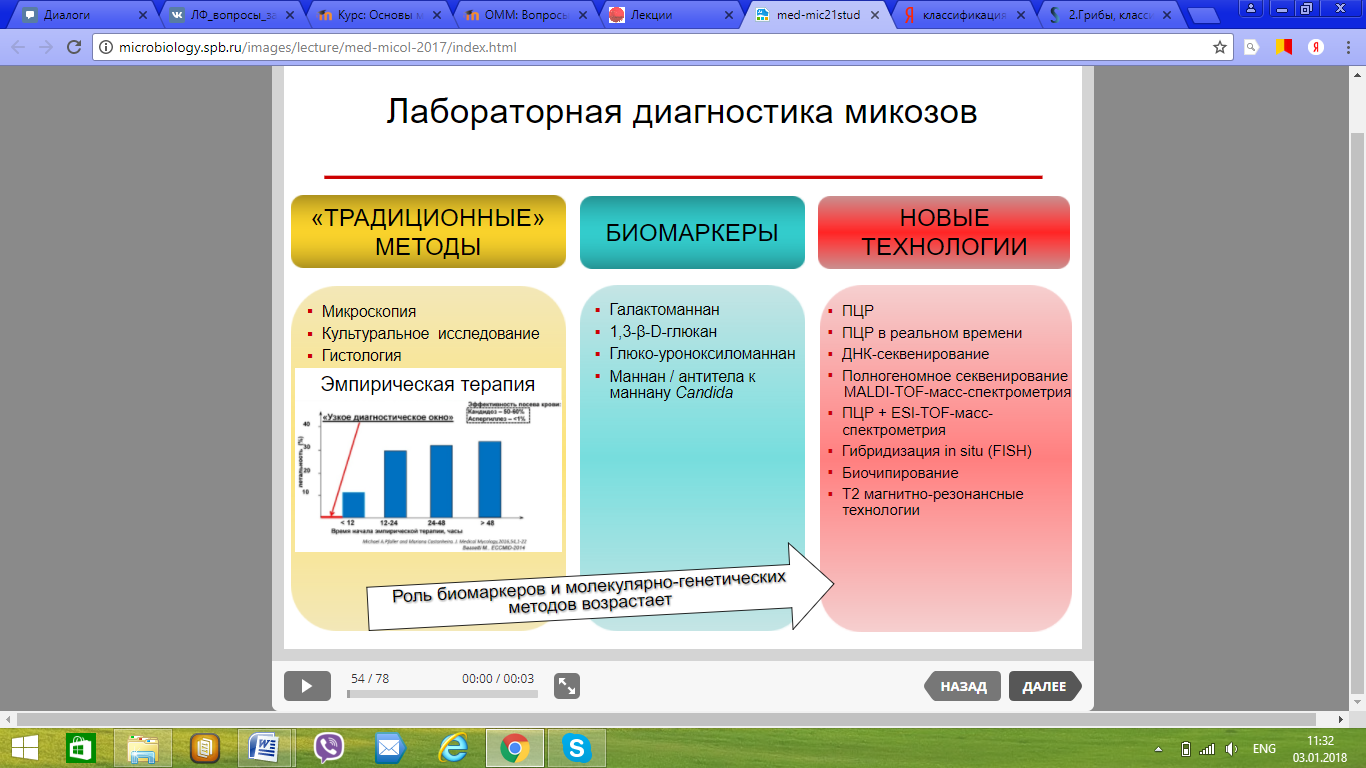
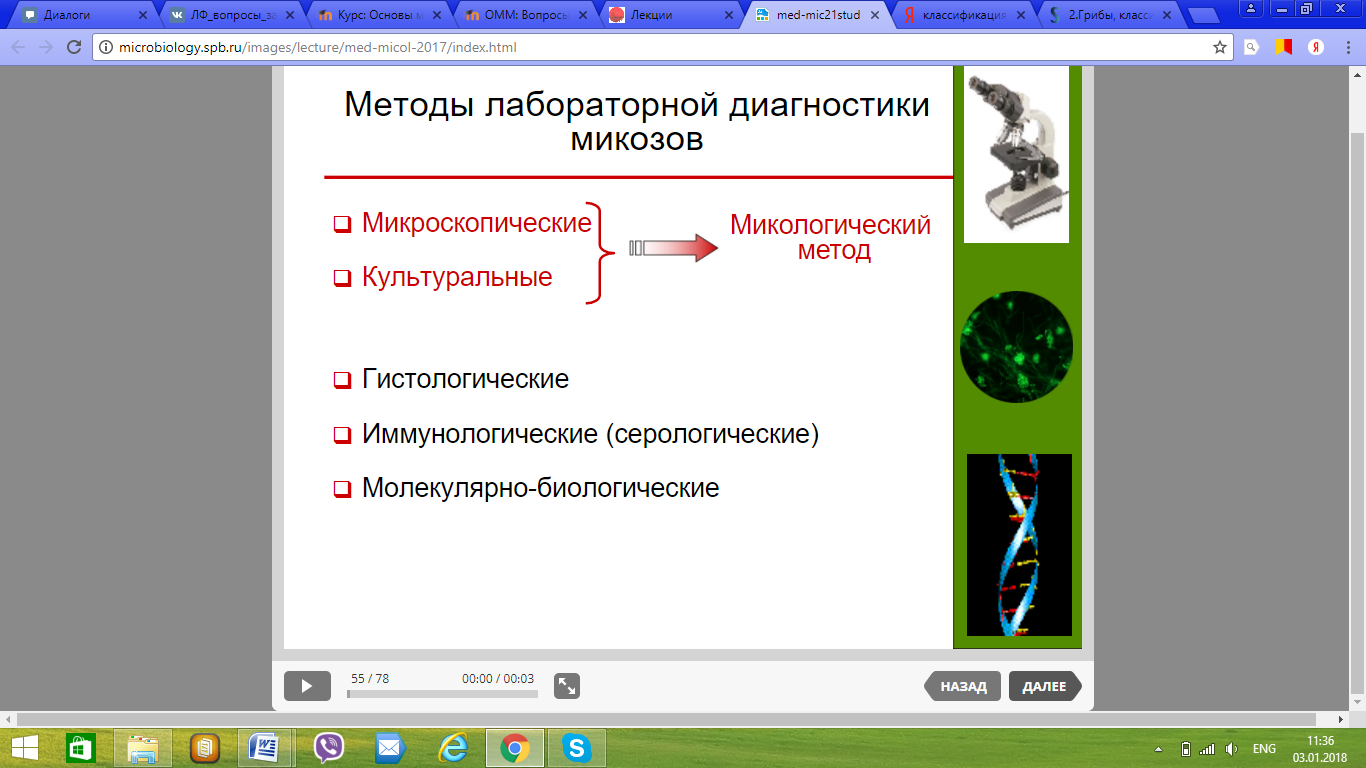
111. Принципы лабораторной диагностики микозов.
112. Стафилококки. Характеристика. Лабораторная диагностика стафилококковых инфекций. Стафилококковое носительство. Относятся к семейству Micrococcoceae. Род Staphylococcus включает 19 видов, из которых патогенны для человека только некоторые: S.aureus, S.epidermidis и S.saprophyticus. Заболевания вызывают золотистые, реже – эпидермальные и еще реже – сапрофитные стафилококки. Морфология, физиология. Отдельные клетки имеют форму правильного шара, при размножении образуют скопления в виде гроздьев винограда (slaphyle – виноградная гроздь). Размер от 0,5 до 1,5 мкм. В препаратах из патологического материала (из гноя) располагаются поодиночке, парами или небольшими скоплениями. Золотистые стафилококки имеют способность образовывать нежную капсулу. Стафилококки – факультативные анаэробы, но лучше развиваются в аэробных условиях, Гр+. На поверхности плотных питательных сред образуют круглые, выпуклые, пигментированные (золотистые, палевые, лимонно-желтые, белые) колонии с ровными краями; в жидких – равномерное помутнение. В лабораториях используют способность стафилококков размножаться в средах с большим количеством (6-10 %) NaCl (ЖСА). Такую концентрацию соли другие бактерии не переносят Þ солевые среды являются элективными для стафилококков. Штаммы золотистых стафилококков, продуцирующие гемолизины, дают на кровяном агаре колонии, окруженные зоной гемолиза. Стафилококки имеют ряд ферментов, расщепляющих многие углеводы, белки. Дифференциально-диагностическое значение имеет тест на сбраживание глюкозы в анаэробных условиях. Из ферментов, участвующих в патогенезе стафилококковых инфекций, только плазмокоагулаза и частично ДНКаза характерны для S.aureus. Другие ферменты (гиалуронидаза, протеиназа, фосфатаза, муромидаза) непостоянны (но чаще продуцируются S.aureus). Стафилококки ситезируют бактериоцины. Устойчивы к пенициллину (пенициллиназа). Антигены. Вещества клеточной стенки: пептидогликан, тейхоевые кислоты, белок А, типоспецифические агглютиногены, а также капсула, имеющая полисахаридную природу. Пептидогликан имеет общие АГ с пептидогликанами микрококков и стрептококков. Антигенность тейхоевых кислот связана с аминосахарами. Белок А золотистого стафилококка способен к неспецифическому соединению с Fc-фрагментом IgG, в связи с чем он агглютинируется нормальной человеческой сывороткой. У стафилококков есть 30 белковых типоспецифических антигенов. Но внутривидовая дифференциация по Аг структуре в практике не используется. Патогенность. Повреждающее действие на клетки и ткани организма человека оказывают токсины и ферменты. Также к факторам патогенности можно отнести капсулу, препятствующую фагоцитозу и связывающую комплемент, а также белок А, инактивирующий комплемент и тормозящий опсонизацию при взаимодействии с Fc-фрагментом IgG. S.aureus способен выделять ряд токсинов, в частности лейкоцидин, который оказывает губительное действие на фагоцитирующие клетки, главным образом на макрофаги. Гемолизины (α, β, дельта, γ) оказывают лизирующее действие на эритроциты человека и животных (кролика, лошади, барана). Основным из них является α-токсин, продуцируемый S.aureus. Помимо гемолитического, этот яд обладает кардиотоксическим действием, вызывает спазм коронарных сосудов и остановку сердца в систоле, он поражает нервные клетки и нейроны, лизирует мембраны и лизосомы клеток, что приводит к освобождению лизосомальных ферментов. Возникновение пищевых отравлений стафилококковой природы связано с действием энтеротоксинов, продуцируемых золотистыми стафилококками. Известно 6 антигенов различных энтеротоксинов (АВСDЕF). Эксфолиативные токсины вызывают у новорожденных пузырчатку, локальное буллезное импетиго, генерализованную скарлатиноподобную сыпь. Заболевания сопровождаются внутриэпидермальной отслойкой эпителия кожи, образованием сливающихся пузырей, жидкость в которых стерильна. Фокус стафилококковой инфекции находится чаще всего при этом в пупочной ранке. Экзоверменты: плазмокоагулаза осуществляет свертывание плазмы (белки как бы одеваются в фиброзный чехол, защищающий их от фагоцитоза). Большие концентрации коагулазы, в организме больного, приводят к уменьшению свертываемости периферической крови, нарушению гемодинамики, прогрессирующему кислородному голоданию тканей. Гиалуронидаза способствует распространению стафилококков в тканях. Лецитиназа разрушает лецитин, входящий в состав оболочек клеток, вызывает лейкопению. Фибринолизин растворяет фибрин, отграничивающий местный воспалительный очаг, чем способствует генерализации патологического процесса. Патогенетические свойства других экзоферментов стафилококков (ДНКаза, мурамидаза, протеиназа, фосфатаза), часто сопровождающих коагулазную активность, еще не определены. Экология и распространение. В первые дни жизни человека стафилококки поселяются на слизистых оболочках рта, носа, в кишечнике, а также на коже, входят в состав формирующейся нормальной микрофлоры тела человека. Стафилококки постоянно поступают в окружающую среду от человека. Они присутствуют на предметах обихода, в воздухе, в воде, в почве, на растениях. Но их болезнетворная активность различна, особое внимание уделяется золотистым стафилококкам как потенциально патогенным для человека. При контакте с источником инфекции носителями S.aureus становятся не все люди. Формированию бактерионосительства способствуют низкое содержание SIgA в носовом секрете и другие проявления функциональной недостаточности иммунной системы. У таких лиц формируется резидентное носительство, т.е. постоянным местом обитания стафилококков становится слизистая оболочка носа, на которой микроорганизмы интенсивно размножаются и выделяются в окружающую среду массивными дозами. В лечебных учреждениях их источником являются больные с открытыми гнойно-воспалительными процессами (инфекция передается контактным путем). Этому способствует длительность выживания стафилококков на окружающих предметах. Хорошо переносят высушивание, пигмент защищает их от губительного действия солнечного света (прямые солнечные лучи убивают их только через несколько часов). При комнатной температуре они остаются жизнеспособными на предметах ухода за больным в течение 35–50 дней, на предметах твердого инвентаря – десятки дней. При кипячении гибнут мгновенно, чувствительны к дезинфектантам, к бриллиантовой зелени, что позволяет широко применять её для лечения поверхностных воспалительных заболеваний кожи. Патогенез заболеваний человека. Способны поражать любую ткань человеческого организма. Это местные гнойно-воспалительные процессы (фурункулы, карбункулы, нагноения ран, бронхиты, пневмонии, отит, ангина, конъюнктивит, менингит, эндокардит, энтероколит, пищевые отравления, остеомиелит). Генерадизация любой формы местного процесса завершается сепсисом или септикопиемией. У лиц с иммунодефицитными состояниями стафилококковые инфекции развиваются чаще. Иммунитет. Взрослые устойчивы, т.к. имеют естественные защитные механизмы и специфические антитела, которые приобретаются в течение жизни при контакте с больными и носителями. В процессе стафилококковой инфекции возникает сенсибилизация организма. В формировании иммунитета имеют значение как антимикробные, так антитоксические и антиферментные антитела. Степень защиты определяется их титром и местом действия. Большую роль играют секреторные IgA, обеспечивающие местный иммунитет слизистых оболочек. Антитела к тейхоевым кислотам определяются в сыворотках крови взрослых и детей с тяжелыми стафилококковыми инфекциями: эндокардитом, остеомиелитом, сепсисом. Лабораторная диагностика. Материал (гной) подвергают бактериоскопии и высевают на питательные среды. Кровь, мокроту, фекалии исследуют бактериологическим методом. После выделения чистой культуры по ряду признаков определяют видовую принадлежность. В случае выделения S.aureus определяют плазмокоагулазу, гемолизин, А-протеин. Серодиагностика: РП (альфа-токсин), РНГА, ИФА. Для установления источника и путей распространения инфекции, выделенные культуры фаготипируют. Лабораторный анализ непременно включает определение чувствительности выделенной культуры или культур к антибиотикам. Профилактика и лечение. Профилактика направлена на выявление носителей S.aureus, главным образом среди персонала медицинских учреждений, с целью их санации. Особое внимание уделяется профилактике стафилококковых инфекций у новорожденных. Для лечения острых стафилококковых заболеваний назначаются антибиотики, выбор которых определяется чувствительностью выделенной культуры к набору препаратов. При септических процессах вводят противостафилококковый иммуноглобулин или антистафилококковую плазму. Для лечения хронических стафилококковых инфекций (хрониосепсис, фурункулез и др.) применяют стафилококковый анатоксин, аутовакцину, которые стимулируют синтез антитоксических и антимикробных антител.
113. Стрептококки. Характеристика. Лабораторная диагностика стрептококковых инфекций. РодStreptococcus, семействоStreptococcaceaeвключает 21 вид. Чащевсеговызываютзаболевания: S.pyogenes, agalacticae, faecalis, зеленящие (pneumoniae). Пиогенные стрептококки Морфология. Гр+, шаровидной или овальной формы. В мазках располагаются парами или короткими, 6–8 клеточными, цепочками. Имеют капсулу, но входящая в ее состав гиалуроновая кислота не антигенна. Неподвижны, спор не образуют. Стрептококки КУЛЬТИВИРУЮТСЯ на питательных средах с добавлением глюкозы, сыворотки или крови. На поверхности плотных сред образуют мелкие (до 1 мм)бесцветные колонии, в жидких средах – придонный, пристеночный рост, при этом среда прозрачная. По характеру роста на кровяном агаре различают: бета-гемолитические – вокруг колоний образуется прозрачная зона гемолиза; альфа-гемолитические – неширокая, зеленоватая зона; негемолитические – среда не изменяется. Продуцируют ряд ферментов, дифференциально-диагностическое значение имеет лактаза и сахараза. АГ. По АГ составу полисахоридной клеточной стенки (субстанция С) стрептококки разделяют на 20 серогрупп (обозначают заглавными буквами латинского алфавита А–V). Внутри серогрупп стрептококки разделяют на серовары (обозначают цифрами). Большинство возбудителей стептококковых инфекций относится к серогруппе А. АГ свойствами обладают Ig-новые Fc-рецепторы клеточной стенки, липотейхоевые кислоты, а также токсины и ферменты, секретируемые в окружающую среду при размножении микроорганизмами. Патогенность для человека определяется образованием токсинов, внеклеточных ферментов и свойствами самих бактериальных клеток. Перечень заболеваний, вызываемых стрептококками, довольно большой: ангины, хронический тонзиллит, скарлатина, гнойные поражения кожи, флегмоны, сепсис, нефрит, ревматизм, отит и др. Попытки найти дифференциальные признаки стрептококков, вызывающих столь разнообразные по клиническим проявлениям болезни, оказались безуспешными. Только в отношении скарлатинозного стрептококка установлено, что они могут выделять эритрогенный токсин, другие признаки одинаковы с другими стрептококками СЕРОЛОГИЧЕСКОЙ ГРУППЫ А. Нефритогенными считаются стрептококки серовара 12, продуцирующие цитотоксин. Стрептококки серогруппы В (S. agalactia) могут вызывать послеродовые инфекции и сепсис новорожденных, эрозивный стоматит, урогенитальные инфекции у женщин, сепсис, менингит. С – возбудители респираторных инфекций, заболеваний МПС. Ни К– выделены при эндокардитах. D(энтерококки) – обитают в кишечнике здорового человека, вызывают поражения желчевыводящих путей, могут вызвать эндокардит, попадая в раны гнойно-воспалительную инфекцию. При генерализации – сепсис. Некоторые (S.mutans, S.salivarius и др.), не содержащие группового Аг, обитают в полости рта. S.mutans участвует в развитии кариеса зубов и пародонтоза. Стрептококки других серогрупп редко обнаруживаются у человека. Факторы патогенности. Адгезины – это липидный компонент комплекса липотейхоевой кислоты с белками клеточной стенки, обеспечивают взаимодействие с мембраной эпителия и колонизацию. Защиту от фагоцитоза обеспечивают: 1) антихемотаксический фактор; 2) Ig-новый Fc-рецептор (к IgG) – подавляет фагоцитоз, разрушает комплемент, вызывает дисбаланс иммуноглобулинов; 3) капсула (у серогрупп А и В) – защищает от фагоцитов; 4) М-белок, позволяет расти и размножаться в крови человека, лишенные М-белка клетки фагоцитируются без участия антител. М-белок обеспечивает т/же способность проникать в клетки микроорганизмов и размножаться в них. ФЕРМЕНТЫ: гиалуронидаза (фактор распространения) и стрептокиназа (фибринолизин) – разрушает фибрин, ограничивающий местный очаг воспаления, способствуя генерализации процесса. Стрептококки СЕРОГРУППЫ Аобразуют ряд ТОКСИНОВ: О-стрептолизин (термолабильный белок) – выделяется при размножении, вызывает лизис эритроцитов, разрушает мембраны других клеток, а также мембраны лизосом, обладает кардиотоксическим действием. Этот токсин является АГ и стимулирует синтез анти-О-стрептолизин. S-стрептолизин (нуклеопротеид), антигенными свойствами не обладает, вызывает лизис эритроцитов, разрушает лизосомы, мембраны митохондрий клеток человека. Лейкоцидин лизирует полиморфноядерные лейкоциты, выключает фагоцитоз. Цитотоксины (пептиды) – повреждают клетки. Один из этих токсинов способен повреждать почечную ткань, он выделяется нефритогенными штаммами стрептококков серовара 12. Эритрогенный токсин (скарлатинозный). Информация об образовании данного токсина поступает в клетку с геномом умеренного фага. Термостабильная фракция эритрогенного токсина стимулирует реакцию ГЗТ. Экология и распространение. Выделяют возбудителей заболеваний только человека, человека и животных и условно-патогенные для человека. Обитают в полости рта, на слизистых оболочках верхних дыхательных путей, на коже, в кишечнике. Источник – больные и бактерионосители. Путь распространения – воздушно-капельный. Значительная часть заболеваний – эндогенные инфекции, возникают у лиц с иммунодефицитными состояниями. В окружающей среде (на предметах обихода, в пыли) могут сохраняться в течение нескольких дней, хорошо выдерживают высушивание (сохраняют жизнеспособность, но теряют вирулентность). Чувствительны к нагреванию и дезинфектантам. Иммунитет. На развитие стрептококковых инфекций влияет состояние микроорганизмов. Часто заболевание развертывается на фоне предварительно возникшей сенсибилизации (повторные ангины, рожистые воспаления, хронические инфекции – тонзиллит, нефрит, ревматизм). Возможно участие аутоиммунных процессов (ревматизм). Имеют АГ, перекрестно реагирующий с сарколеммой мышечных волоконсердца. Антитела вырабатываются на все БАВ стрептококка (токсины, ферменты). Иммунитет после перенесенных инфекций (кроме скарлатины) малонапряженный и носит типовой антимикробный характер (к М-антигену). Антитела к ферментам, токсинам стрептококков протективными свойствами практически не обладают. Уровень напряженности сенсибилизации проверяют в аллергических пробах. Лабораторная диагностика. Материалом для БАКТЕРИОЛОГИЧЕСКОГО исследования служат слизь из зева, гной, отделяемое ран, кровь и др. Выделенные чистые культуры идентифицируют, определяют основные их свойства: морфологию, гемолитическую активность, чувствительность к антимикробным препаратам.СЕРОЛОГИЧЕСКАЯ ДИАГНОСТИКА – выявление антител к токсинам и ферментам. При ревматизме – нарастание титров анти-О-стрептолизинов, анти-ДНКазы, антигиалуронидазы в парных сыворотках. Профилактика и лечение. Специфическая профилактика не разработана. Для предупреждения хронических стрептококковых инфекций, связанных с персистенцией возбудителя и образованием L-форм, используют антибиотикотерапию. За детьми, перенесшими повторные ангины, скарлатину, устанавливается диспансерное наблюдение (профилактика ревматизма). Стрептококки серогруппы А высокочувствительны к пенициллину (бактерицидное действие), устойчивость к пенициллину не приобретается. Сульфаниламиды оказывают бактериостатическое действие на стрептококки. К ним микроорганизмы легко приобретают резистентность. Особое место занимает СКАРЛАТИНА– острое инфекционное заболевание, возбудитель – гемолитический стрептококк группы А любого серовара, способный продуцировать эритрогенный токсин. Патогенез. Скарлатина – острозаразное заболевание, протекает циклически со сменой симптомов. На 1 этапе проявляется действие эритрогенного токсина (интоксикация, ангина, мелкоточечная сыпь на гиперемированном фоне). 2 период сопровождается осложнениями в рез действия самих стрептококков (гнойные лимфаденит, мастоидит, отит), т.к. антимикробный иммунитет не выражен, и заражение стрептококками других сероваров, к которым нет соответствующих антител. Иммунитет. В отличие от других стрептококковых инфекций остается прочный антитоксический иммунитет, т.к. эритрогенный токсин стрептококков всех сероваров АГ-но идентичен. Антимикробный иммунитет типоспецифичен и не защищает от возникновения других стрептококковых заболеваний. Напряженность антитоксического иммунитета к эритрогенному токсину проверяется внутрикожными пробами. При отсутствии иммунитета самая малая доза токсина дает покраснение и припухлость кожи. Если же в крови есть антитоксины, реакции на введение токсина не возникает. Стрептококки пневмонии (ПНЕВМОКОККИ).S.pneumoniae – вызывают воспаление легких – пневмонию, что объясняется специфичностью адгезинов, взаимодействующих с рецепторами клеток лёгких. Морфология, физиология. Им вытянутую форму, напоминающую пламя свечи. Располагаются попарно, каждая пара окружена капсулой. Под капсулой расположен М-белок, по свойствам схожий с S.pyogenes, но имеющий свою АГ специфичность. На плотных питательный средах, в которые добавлена сыворотка или кровь, пневмококки растут, образуя мелкие колонии, окруженные зоной позеленения (на кровяном агаре). В жидких средах дают равномерную муть. БХ активность выражена умеренно – расщепляют ряд углеводов и образуют гиалуронидазу, муромидазу, пептиназу. Имеют 3 основных АГ: полисахаридный АГ клеточной стенки, капсульный антиген и М-белок. По капсульному АГ разделяются на 84 серовара. Экология и распространение. Обитают в верхних дыхательных путях человека, попадают в нижние дыхательные пути и при застойных явлениях в легких, снижении активности SIgA и макрофагов, разрушении сурфактанта возникает эндогенная пневмония. Заражение воздушно-капельным путем. Вне организма пневмококки быстро погибают. Они не выдерживают нагревания, дезинфекции. В высушенной мокроте могут сохраняться длительное время. Чувствительны к пенициллину, макролидам. Патогенность. Образуют гемолизины и лейкоцидин, повреждающие клетки тканей. М-белок и капсула обеспечивают способность к адгезии и устойчивость к фагоцитозу. Выделяющиеся ферменты играют большую роль в развитии патологического процесса:пептидаза расщепляет SIgA, гиалуронидаза способствует распространению микроорганизмов в тканях. При воздействии токсинов и ферментов макрофаги под сурфактантом могут покинуть «линию обороны». Возможна генерализация процесса, которая чаще бывает у детей раннего возраста и пожилых людей. В этих случаях возникают менингит, сепсис. Иммунитет. Типоспецифический и нестойкий, это объясняет повторное возникновение и возможность перехода в хроническую форму. Лабораторная диагностика. Для выделения клеток возбудителя необходимо: оптимальная для размножения питательная среда, условия культивирования, правильное взятие исследуемого материала. Выделенные клетки идентифицируют по ряду признаков и дифференцируют от зеленящего (альфа-гемолитического) стрептококка, энтерококков. Пневмококки, имеющие капсулу, подвергают серологическому типированию и определяют чувствительность микроорганизмов к антимикробным препаратам. Профилактика и лечение. Специфическая профилактика не разработана. В каждом частном случае имеют значение неспецифические мероприятия, направленные на предупреждение возможности возникновения эндогенной инфекции: у больных, вынужденных длительное время лежать, находящихся на гормональной, лучевой терапии, и при снижении общей резистентности организма проводится стимуляция естественных защитных механизмов (режим питания, витаминизация, усиление вентиляции легких массажем и прочими воздействиями). Для лечения пневмонии используют пенициллин, макролидные антибиотики. ЭНТЕРОКОККИ.S.faecalis (фекальные стрептококки, энтерококки) являются обитателями кишечника человека и теплокровных животных. Входят в группу D. Морфологически– это шаровидные или овальные бактерии, при делении соединяются в пары или короткие цепочки. Полиморфны, некоторые штаммы подвижны, имеют 1–4 жгутика. Ферментация отдельных углеводов – непостоянный признак. Экология и распространение. Энтерококки более устойчивы к действию факторов окружающей среды, чем другие стрептококки. Они выдерживают нагревание до 60°С в течение 30 мин, способны размножаться в средах с 6,5 % NaCI, 40% желчи, при рН 9,5–10,0. Теллурит калия, азид натрия, желчные соли, кристаллический фиолетовый, налидиксовая кислота, а также пенициллин, неомицин не угнетают роста энтерококков, что используется для создания элективных питательных сред. Патогенез. Способны размножаться в пищевых продуктах, при употребление зараженной пищи развивается пищевая токсикоинфекция. Чаще ее вызывают протеолитические варианты. Гнойно-воспалительные процессы протекают обычно вяло, хронически. Чаще возникает не моноинфекция, а смешанная, в ассоциации с кишечной палочкой, протеем, стафилококками. Из гноя, отделяемого ран, верхних дыхательных путей, где локализуются патологические процессы, выделяются гемолитические варианты S.faecalis.Большинство штаммов энтерококков, выделяемых от больных, оказываются устойчивыми к пенициллину, неомицину, обладают ферментами патогенности – коагулазой, гиалуронидазой, ДНК-азой, фибринолизином, протеиназой, муромидазой. При пересевах в лаборатории эти ферменты обычно перестают выделяться.
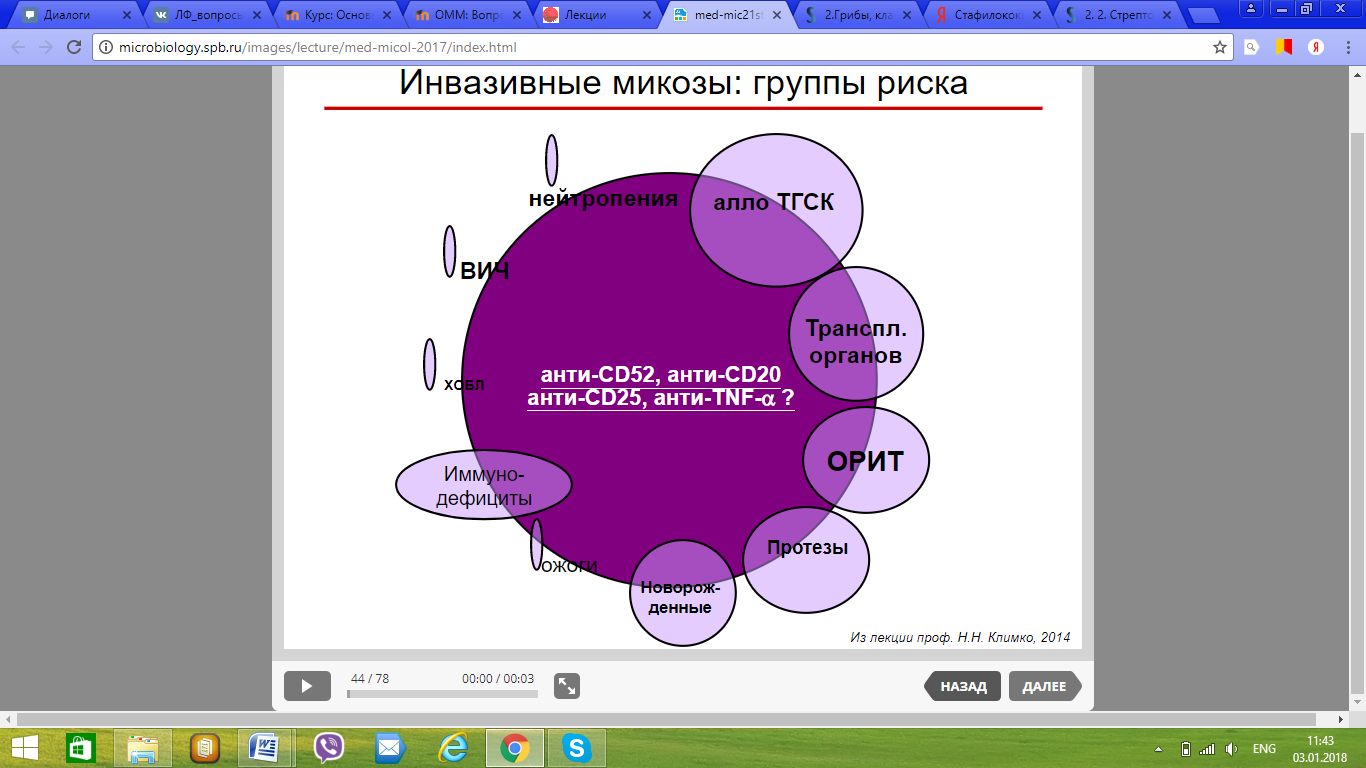
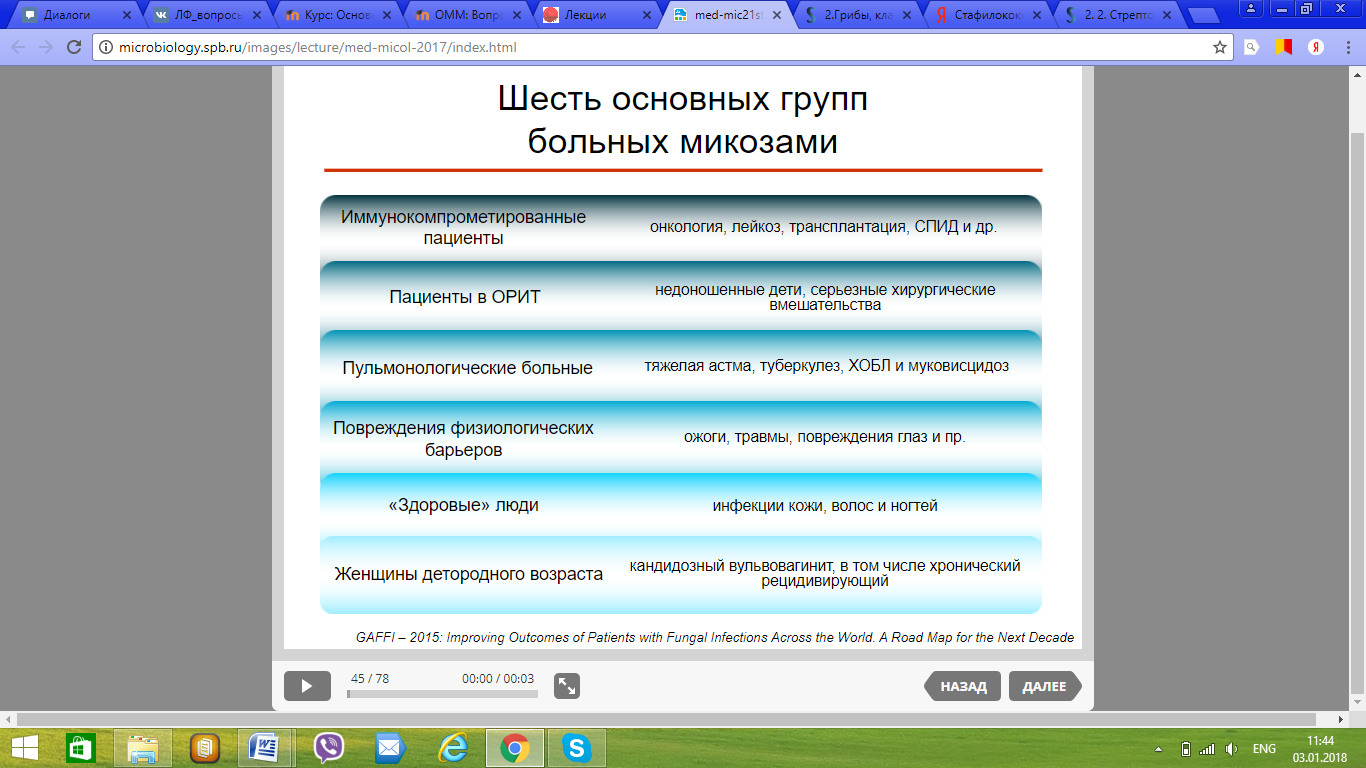
114. Факторы риска развития микозов. Шесть основных групп больных микозами.
115. Характеристика возбудителей гепатитов. Методы диагностики и профилактики.
Вирусные гепатиты - гpyппa инфекций, включающая более 5 самостоятельных нозологических форм, имеющих свои патогенетические, клинические и эпидемиологические особенности. Все инфекции объединяет ярко выраженная гепатотропность возбудителей и связанные с этим биохимические и клинические проявления поражения печени. К настоящему времени удалось идентифицировать 5 возбудителей вирусных гепатитов - А, В, С, Д, Е. Роль вируса гепатита G и TTV в развитии заболевания печени в настоящий момент изучается. Гепатиты А и Е объединяет фекально-оральный механизм передачи, который обеспечивает вовлечение большого количества людей в эпиде-мический процесс, часто проявляющийся в виде вспышек и даже эпидемий. Гепатиты В, С и Д объединяет парентеральный, малоактивный путь передачи, но циркуляция вирусов в человеческой популяции поддерживается длительной вирусемией у источников инфекции, редкой манифестацией заболевания и частой хронизацией патологического про-цесса. Указанные особенности способствуют сохранению возбудителей ВГ, как биологических видов. Многочисленными исследованиями показано, что ВГ широко распространены в мире. Ежегодно этими инфекциями заболевают десятки миллионов людей, а экономический ущерб, наносимый обществу, измеряется миллиардами долларов. Наиболее изученными являются ГА и ГВ, что объясняется наличием четких клинико-лабораторных критериев их диагностики. Манифестная заболеваемость в основном определяется ГА, доля которого в структуре ВГ может достигать 60-80% и более, в тоже время на некоторых территориях наблюдается превалирование ГВ. Отмечается глобальная тенденция повышения заболеваемостью ГВ во всем мире. ГЕПАТИТ А Этиология Вирус ГА относится к роду Гепатовирус семейства Picornaviridaе. Вирус был идентифицирован только лишь в 1973 году Фейнстоном. Вирион имеет форму икосаэдрической частицы размером 27-32 нм. ВГА не обладает внешней оболочкой - суперкапсидом и поверхностными выступами, сердцевинный компонент в вирионе отсутствует. На поверхности вирионов имеются 32 капсомера. Белковая часть ВГА состоит из четырех различных полипептидов (VPI - VP4). Выявлен только один серотип вируса, связанный с единственным антигеном белковой природы, но, в тоже время, существует 7 гонотипов вируса, из которых 4 – изолированы от человека, а 3 – от обезьян. Геном состоит из односпиральной линейной молекулы +РНК. Вирус ГА устойчив во внешней среде. Не инактивируется эфиром или хлороформом, устойчив к действию кислой и щелочной среды в диапазоне рН от 3,0 до 9,0. При комнатной температуре сохраняет активность в течение нескольких недель, при температуре 4 °С - в течение нескольких лет. Инфекционная активность утрачивается при кипячении в течение 5 мин. ВГА может репродуцироваться в клеточных культурах - в первичных, диплоидных и перевиваемых культурах клеток человека и обезьян, однако цитопатический эффект как правило, отсутствует. Эпидемиология ГА распространен повсеместно, для него характерна цикличность развития эпидемического процесса и выраженная сезонность (для большинства стран северного полушария – осенне-зимняя). Источниками инфекции являются больные острыми манифестными,, бессимптомными и другими формами инфекции. Наиболее интенсивно вирус в окружающую среду выделяется в конце инкубационного периода,, наибольшую эпидемическую опасность представляют больные с безжелтушными и инаппарантньми формами инфекции, которые преобладают у больных ГА. Например, только 10 -15% пациентов с серологически подтвержденным диагнозом ГА отмечают в анамнезе «желтуху». ГА – это инфекция с фекально-оральным механизмом передачи, роль воздушно-капельного пути передачи в настоящее время отрицается. Специфическими факторами передачи возбудителя являются питьевая вода и пищевые продукты, выделяют также контактно-бытовой путь передачи. Водные вспышки могут возникать в результате попадания в водопроводную сеть сточных вод при фекальном загрязнении водоемов. При пищевых вспышках инфицирование происходит вследствие употребления пищевых продуктов, не подвергавшихся термической обработке или контаминированных персоналом в процессе их приготовления. К таким продуктам относятся: салаты, холодные закуски, молоко, молочные продукты, свежие фрукты и овощи, соки. Известны вспышки ГА при употреблении в пищу устриц, так как моллюски способны накапливать вирусы в случае нахождения в загрязненной воде. Крайне редко встречаются случаи посттрансфузионного ГА, обусловленные краткостью периода вирусемии и отсутствием хронических форм болезни. Среди гомосексуалистов отмечается передача ГА в ре-зультате орально-генитальных сексуальных контактов. К группам повышенного риска ГА можно отнести организованные контингенты: детские коллективы в дошкольных и школьных учреждениях; военнослужащие; работники управлений «Водоканализация»; пациенты лечебных учреждений для умственно отсталых лиц; путешественники, отправляющиеся в эпидемически неблагополучные по ГА районы. Патогенез ГА Патогенез ГА - один из наименее изученных вопросов. Входные ворота инфекции - пищеварительный канал. Место первичной репликации вируса точно не установлено. Это может быть эпителий слизистой оболочки и региональные лимфатические узлы кишечника, либо клетки печени, либо ротоглотка, слюнные железы и прилежащие к ним лимфатические узлы. В печень вирус может проникнуть либо лимфогенно и гематогенно,, либо из двенадцатиперстной кишки против тока желчи и через эпителий желчных путей. В печени происходит репликация вируса, затем вирус выделяется с желчью в кишечник и выводится из организма с испражнениями больного. Гепатоциты поражаются: 1. во-первых, в результате цитопатического действия вируса; 2. и, во-вторых, под действием факторов клеточного иммунитета. Основное значение в элиминации-уничтожении вируса, принадлежит процессу лизиса пораженных гепатоцитов натуральными киллерами, активированными интенсивным синтезом интерферонов; 3. антитела к ВГА образуются рано и вместе с лимфоцитами-киллерами определяют антителозависимый цитолиз гепатоцитов. В патогенезе ГА выделяют фазу вторичной вирусемии, которая заканчивается повышением уровня иммунной защиты и очищением организма от возбудителя. Клиника ГА – острая антропонозная инфекция, характеризуется разнообразием течения заболевания, от бессимптомных до ярких манифестных форм.. Общепризнанно, что хронизация процесса не свойственна для ГА. Выделяют следующие формы ГА: 1. С клиническими проявлениями, к которым относятся желтушная - с цитолитическим синдромом или с холестатическим синдромом) и безжелтушная формы; В клинической картине различают три основных варианта течения преджелтушного периода: - диспепсический (наблюдаются тошнота, рвота, расстройства стула, боли в животе, в области печени); - катаральный или гриппоподобный (наблюдаются обще инфекционные симптомы и проявления катарального воспаления верхних дыхательных путей - кашель, боли в горле при глотании, заложенность носа, реже насморк); - артралгический или ревматоидный (наблюдаются симптомы поражения опорно-двигательного аппарата). Как правило, за 1-2 дня до появления желтухи обесцвечивается кал и темнеет моча. С появлением эктеричности склер начинается желтушный период, с исчезновением желтухи начинается период реконвалесценции. 2. Без клинических проявлений - субклиническая и инаппарантная фор-мы. Диагностика Наиболее широко для диагностики ВГ, в том числе и ГА, применяются биохимические методы исследования (ферментные тесты, определение билирубина, белковые пробы). Наибольшее значение при этом имеет определение активности в сыворотке крови аминотрансфераз - АлАТ и аспартатаминотраноферазы АсАТ. При острых ВГ отмечается повышение активности этих ферментов в инкубационном, преджелтушном и желтушном периодах. Из специфических методов диагностики вирусных гепатитов можно упомянуть иммунную электронную микроскопию (ИЭМ), Радиоиммунный анализ (РИА) и иммуноферментный (анализ ИФА) применяют как для обнаружения антигена ВГА, так и для определения антител. Эти методы высокоспецифичны и чувствительны (так, например, антиген ВГА определяется даже при его концентрации всего 1 нг/мл). Гепатит В Этиология Вирус ГВ (частица Дейна) - это ДНК-содержащий вирус, относящийся к семейству Гепадновириде, род Ортогепадновирус,имеющий тропизм к печеночной ткани. Вирус имеет сферическую внешнюю (суперкапсид) липид-белковую внешнюю оболочку диаметром 42-47 нм, которая состоит из повторяющихся структур поверхностного HBs-Аг с расположенными на внешней стороне вируса участками preS1- и preS2 - антигенами. Внутри суперкапсида размещается сердцевина вируса (кор) с внутренним коровым (капсидным) покрытием диаметром 25-27 нм. В капсиде упакованы нуклеопротеиновый комплекс генома, вирусная ДНК-зависимая ДНК-полимераза и обратная транскриптаза – РНК-зависимая ДНК-полимераза. Bнутренняя оболочка вируса состоит белковых структур, иммунологически идентифицируемых как НВс-антиген. При частичной денатурации НВс-антигена обнаруживается другой внутренний структурный белок вируса - НВе-антиген (антиген инфекционности), который может секретироваться. В коре располагается также и еще один антиген - НВх-антиген с не совсем понятной функцией. В сыворотке крови больных и инфицорованных, кроме частиц Дейна обнаруживаются в больших количествах малые сферические и продолговатые, тубулярные, белковые частицы вирусного происхождения диаметром 20-22 нм. Эти неинфекционные частицы внутри полые, не содержат ДНК вируса, состоят из HBs-антигена с небольшим содержанием ргеS2-антигена. Геном вируса небольшой, состоит из 3200 пар нуклеотидов, представляет собой кольцевую ДНК с незавершенной двухцепочечной структурой. Длинная "-" - цепь содержит всю последовательность генов, достаточную для обеспечения структуры и жизнедеятельности вируса. Короткая "+" - цепь ДНК варьирует по длине и составляет только 50-80 % от длины "-" - цепи. Геном содержит 4 открытых рамки считывания, обозначаемых по соответствующим, частично перекрывающимся генам: S, С, Р, X. Ген S кодирует 226 аминокислотных остатков основного белка оболочки - HBs-антигена. Рядом с этим геном расположена пре-S-область, кодирующая preS1 и preS2 антигены ВГВ. Ген С кодирует 212 аминокислотных остатков корового белка капсида - НВс-антигена и внутреннего НВе-антигена. Рамка считывания гена Р кодирует самую длинную последовательность из 832 аминокислотных остатков, в т.ч. последовательность специфической ДНК-полимеразы вируса. На концах генома расположен ген Х, кодирующий 154 аминокислотных остатка, составляющих полипептиды с регуляторными свойствами, активирующие экспрессию всех вирусных генов, и другие полипептиды с пока еще до конца не установленными функциями. Известны распространенные геномы ВГВ четырех основных субтипов вируса, названные по сочетанию антигенных эпитопов HBs-антигена: adw, ауw, adr и ayr. Известны также субтипы вируса с более сложным сочетанием антигенов, например, суб-тип аdyw и др. Эпидемиология Гепатит В — глобально распространенная вирусная инфекция. Ежегодно в мире регистрируется около 50 млн. больных только с острой гепатит-В инфекцией, из них около 600 тыс. больных умирает. Причиной высокой летальности являются особо тяжелые (фулминантные) формы инфекции, а также суперинфицирование вирусами гепатитов D или С. Летальность при таких формах достигает 80-90 %. ГВ заражаются только от инфицированных людей. Заражение возможно при контакте с кровью, слюной, спермой, вагинальными выделениями, потом и слезной жидкостью острых и хронических больных, от носителей инфекции, а также препаратами инфицированной крови. Пе-редача вируса происходит при нарушении целостности кожных и слизистых покровов, при гемотрансфузиях, при использовании плохо стерилизованного медицинского инструмента. Врожденная ВГВ-инфекция наблюдается у будущего ребенка при внутриутробном инфицировании во время беременности или же передается при родах от больной матери к новорожденному. Часто наблюдается передача ВГВ у внутривенных наркоманов, при гомо- и гетеросексуальных контактах; возможно заражение в парикмахерских, косметических кабинетах через нестерилизованные инструменты и в повседневной жизни. ВГВ отличается исключительно высокой инфекционностью. Заражение возможно при инокуляции очень малых объемов крови больного (0,1-0,5 мкл), т.е. 10-8 – 10-9 мл крови. Вирус устойчив в окружающей среде. При комнатной температуре инфекционность вируса сохраняется 3 мес., в холодильнике - 6 мес., в замороженном виде - 15-20 лет, в высушенной плазме крови - до 25 лет. Вирус устойчив к воздействию эфира и ультрафиолетового излучения. При кипячении ВГВ инактивируется за время более 30 мин., в 1-2 % растворе хлорамина - через 2 ч., при автоклавировании - за 20 мин, в 70-80 % этиловом спирте в течение 2 мин. Опасность и широкая распространенность ГВ связаны с тем, что от 2 до 10% заболевших людей становятся хроническими носителями инфекции, при которой продолжительные обострения болезни чередуются с ремиссией в течение многих лет. При хронической инфекции у 20 % больных развивается цирроз печени и в 30 % случаев - первичный рак печени. По разным оценкам, в настоящее время общая численность больных только хроническим гепатитом В составляет от 1 до 2 миллиардов. Патогенез Гепатит В - одна из самых сложных по патогенезу и разнообразная по своим проявлениям вирусная инфекция. Инкубационный период длится от 2 до 4 месяцев. Продолжительность этого периода короче 35 и более 150 дней нехарактерна для ГВ. Запускающим механизмом всего комплекса патологических про-цессов инфекции в организме служит попадание вируса в кровь и его репродукция в клетках печени. Кстати, ранее считалось, что репродукция вируса ГВ протекает только в гепатоцитах. В настоящее время установлено, что вирусные белки и нуклеиновую кислоту можно также обнаружить и в клетках почек, селезенки, поджелудочной железы, кожи, костного мозга и крови. А теперь о патогенезе. После того, как вирусная частица проникает в цитоплазму клетки и освобождается от внешней оболочки, она попадает в ядро гепатоцита. Там ферменты, а именно вирусная ДНК-зависимая ДНК-полимераза, удлиняют короткую «плюс»-цепь ДНК и репарируют кольцевой двухцепочечный геном. Затем клеточная (гепатоцитная) ДНК-зависимая РНК-полимераза синтезирует РНК-овую копию вирусного генома размером 3,5 тыс. нуклеотидов. Этот транскрипт обозначается прегеномом. После этого прегеном и вирусная РНК-зависимая ДНК-полимераза (обратная транскриптаза, ревертаза) переносятся в цитоплазму клетки, где происходит обратная транскрипция прегенома и синтезируется новая вирусная «минус»-цепь ДНК. После этого прегеном разрушается и начинается синтез «плюс»-цепи вирусной ДНК на матрице «минус»-цепи. Вирусная ДНК, ДНК-зависимая ДНК-полимераза и обратная транскриптаза заключаются в коровый капсид из НВс- и НВе-антигенов и после достройки «плюс»-цепи ДНК могут снова вернуться в ядро клетки для повторной репликации или же с недостроенной цепью ДНК собираться в вирусную частицу в области эндоплазматического ретикулума клетки. В этой области сердцевина нового вируса упаковывается в гликозилированную внешнюю оболочку и окончательно собранный вирион транспортируется через мембрану и выходит из клетки. Таким образом, репродукция вируса в клетке и его выход не вызывают прекращения жизнедеятельности и разрушения гепатоцитов. Некоторые последовательности ДНК вируса часто встраиваются в состав генома гепатоцитов., а именно фрагмент м-РНК, кодирующий белкисуперкапсида вируса. Поэтому, неинфекционные, полые частицы HBsAg в избытке обнаруживаемые в крови носителей инфекции, как раз и являются продуктами экспрессии вирусных генов. Количество частиц HBs-антигена в крови превышает число частиц Дейна в десятки и сотни тысяч раз. Вирионы и поверхностные вирусные антигены покидают клетку без ее разрушения. Следовательно, процессы цитолиза гепатоцитов и развитие гепато-целлюлярного некроза осуществляются с участием эффекторных клеточных и клеточно-гуморальных реакций системы противовирусного иммунитета (нормальные киллеры, Т-киллеры, макрофаги, цитокины, иммуноглобулины). Нарушение дезинтоксикационной функции печени приводит к накоплению в организме токсических веществ и функциональной блокировке печени. Развиваются взаимосвязанные процессы токсикоза организма и аллергии. Как следствие, в патологический процесс вовлекаются другие органы, нарушается работа вегетативной и центральной нервной системы. Клиника ГВ клинически проявляется весьма разнообразно, наиболее часто в виде астено-вегетативного синдрома с лихорадкой, желтухой, гепатомегалией, с дальнейшим развитием синдрома печеночно-клеточной недостаточности, с возможным развитием гепато-церебрального синдрома (печеночной энцефалопатии) и коматозного синдрома при особо тяжелом течении заболевания. Диагностика Любая из названных разновидностей гепатита В обнаруживается наличием хотя бы части специфических антигенов (HBs-, НВс- и НВе-антигены), иммунологических (антитела класса lgM и lgG к этим антигенам) или генетических (нуклеотидные последовательности ДНК ВГВ) маркеров этой инфекции в крови, лимфе, других биологических жидкостях организма, а также в клетках и тканях различных органов. В настоящее время для диагностики заболевания широко используются ИФА и ПЦР. ГЕПАТИТ С ЭТИОЛОГИЯ Вирус ГС был открыт в 1989 году и именно с этого времени началось изучение ВГС-инфекции, обозначаемой как «гепатит ни А, ни В, передающийся парентерально» (ГНАНВП). Удельный вес данной формы гепатита составляет около 15% от всех форм вирусных гепатитов, однако именно этот возбудитель обладает наиболее высоким хрониогенным потенциалом (до 90%) и именно данная инфекция является основной причиной формирования группы хронических болезней печени - хронического гепатита, цирроза печени, гепатоцеллюлярной карциномы. ВГС относится к семейству Флавивирусов, род Гепацивирус, представляет собой небольшой (30-40 нм в диаметре), сложный по строению вирус. Геном представлен одноцепочечной, (+)-РНК, которая кодирует 3 структурных и 6 неструктурных белков вируса. К структурным относятся: - нуклеокапсидный белок-С (core) и - гликопротеины оболочки (Е1-Е2). Неструктурную область представляет комплекс белков с ферментативной активностью (NS1 - NS5а,в). К каждому из белков вириона вырабатываются антитела (анти-ВГС), обнаруживаемые в сыворотке крови. Характерной особенностью ВГС-инфекции является циркуляция вируса в организме человека в минимальных концентрациях, а также крайне выраженная гетерогенность вируса и его слабая иммуногенность, не приводящей к выработке активного иммунитета. В этой связи не исключается возможность повторного инфицирования. Согласно разным классификациям выделяют 6, 11 и более генотипов ВГС, а также более 80 его субтипов. Эпидемиология Гепатит С, подобно гепатиту В, имеет повсеместное распространение. Источниками ВГС являются больные всеми формами острого и хронического ГС. Вирус попадает в кровь при любых парентеральных манипуляциях: - гемотрансфузии, - инъекциях, - при посещении стоматолога и гинеколога, - оперативном вмешательстве, - зондовом обследовании и т.д. К группе риска относятся: больные, находящиеся на гемодиализе, страдающие гемофилией и другими заболеваниями крови, получающие плазму, гемоконцентраты, иммуноглобулины; наркоманы; медицинские работники, имеющие контакт с кровью, например, сотрудники отделений гемодиализа, станций перели-вания крови, клинических лабораторий, хирурги, стоматологи. Уровень инфицированности ВГС среди медицинских работников в среднем в 3-5 раз выше, чем среди обычного населения. Относительно меньшее значение имеют половой, бытовой и вертикальный пути передачи, что связано с низкой степенью виремии. Патогенез Патогенез ГС изучен недостаточно. Предполагается, что вирус оказывает непосредственное цитолитическое действие. Кроме того, большая роль в развитии заболевания принадлежит иммунной системе больного человека. Клиника Отличительной особенностью ГС является малосимптомное, легкое течение часто без формирования желтухи или со стертой желтухой. Нередко имеют место и субклинические формы заболевания, тяжелые формы ГС наблюдаются крайне редко. Начало болезни, как правило, постепенное, желтухе предшествует преджелтушный период, который по своей клинической картине аналогичен преджелтушному периоду при ГВ. Период желтухи при ГС больные переносят легко, редко наблюдаются фульминантные формы и печеночная кома. Главной особенностью ГС является частый переход в хроническое течение и, как правило, постепенно прогрессирующий процесс приводит к развитию цирроза и гепатоцеллюлярной карциномы. Риск развития ГЦК в таком случае в три раза выше, чем при ГВ. Диагностика – те же методы ГЕПАТИТ Д Этиология Гепатит Д (ГД) - инфекция, вызываемая вирусом ГД (или дельта-вирусом), выделенным в 1977 году, представляющим собой дефектную вирусную частицу размером 30-35 нм и состоящую: - из внутреннего антигена (HDAg), - небольшой однонитевой циркулярной молекулы РНК и - поверхностной оболочки - поверхностного антигена вируса ГВ (HBsAg). Для репродукции вируса ГД необходимо присутствие вируса-помощника - вируса ГВ, который не только помогает его репликации, но и проникновению в поражаемую клетку. Поэтому, ГД всегда протекает либо как микст-инфекция (одновременное заражение ВГВ и ВГД, либо как суперинфекция (наслоение ГД на текущую, как правило, хроническую ГВ-инфекцию). Инфицирующая доза составляет 10-11 мл материала. Механизмы и пути передачи ВГД до конца не изучены. Необходимость обязательного присутствия ВГВ для репродукции дельта-вируса позволяет считать, что пути передачи этих возбудителей сходные. Выделены немногочисленные группы риска - в основном лица, применяющие наркотики внутривенно и больные гемофилией Вирус ГД вызывает развитие тяжелых форм острого гепатита, нередко заканчивающихся смертельным исходом. Летальность при острой микст-инфекции ГВ-ГД, составляет от 1 до 10%, при острой суперинфекции - 5-20%. Патогенез Для ГД характерен длительный инкубационный период до 1,5-6 месяцев. Как правило, заражение происходит: - при переливании инфицированной крови или ее препаратов; - инструментами при парентеральных вмешательствах; - а также половым путем. Клинически ГД протекает с высокой и длительной температурной реакцией, спленомегалией, сыпью различного характера, выраженными суставными болями. Биохимические показатели (повышение активности АсАТ и АлАт, активности тимоловой пробы. В большинстве случаев острый гепатит смешанной этиологии завершается выздоровлением. Однако эта форма острого ВГД может приобретать также и тяжелое течение с явлениями развития прекомы и печеночной комы на 4-6 дни от начала желтухи и соответствует фульминантному течению заболевания. У таких больных часто выражен геморрагический синдром, наблюдаются резкие явления общей интоксикации (сознание утрачивается, волевая двигательная и болевая чувствительность отсутствуют). Отсутствие глотательного рефлекса характеризует глубокую кому и, как правило, такие больные погибают Иногда возможен прямо противоположный эффект от инфицирования ВГД - не только выздоровление, но и прекращение хронического носительства ВГВ. ГЕПАТИТ Е (или ВГНАНВ с фекально-оральным путем заражения) Этиология Вирус ГЕ открыт Балаяном в 1983 году. Это РНК-содержащий вирус, но в тоже время, он не принадлежит к семейству Пикорнавирусов, обладает определенными сходствами с Калицивирусами и Тогавирусами. Высказаны предложения выделить новое семейство вирусов и отнести данный вирус именно туда. Вирионы представляют собой округлые частицы размером 32 нм. Суперкапсида нет, геном представлен однонитевой +РНК. Гепатит Е – антропоноз, источниками ГЕ являются больные различными формами инфекции. Эпидемиология ГЕ сходна с эпидемиологией ГА. Для ГЕ характерен водный путь передачи, вероятно реализуется пищевой, а также и контактно-бытовой пути передачи. Боль-шинство вспышек связаны с употреблением загрязненной фекалиями воды, и обычно происходят в период выпадения обильных атмосферных осадков или после наводнений. Водные вспышки ГЕ описаны в Индии, Непале, Алжире, в государствах Средней Азии, т.е. в странах с жарким климатом. Отмечено, что ГЕ чаще болеют взрослые мужчины, чем женщины. Однако среди женщин, особенно беременных, наблюдается значительно больше летальных исходов. Общая летальность от ГЕ во время большинства вспышек составляет 1-5%, среди беременных женщин этот показатель достигает 10-20%. Наиболее тяжелые формы наблюдаются во второй половине беременности. Патогенез Патогенез этого заболевания - один из наименее изученных вопросов вирусных гепатитов. Предполагается, что важнейший фактор в поражении гепатоцитов - цитопатическое действие вируса-возбудителя. В тоже время, имеются сведения, говорящие об участии иммунных механизмов в пораже-нии печеночной ткани. Инкубационный период при ГЕ максимально продолжается до 50 - 60 дней (в среднем 30 дней). В случаях, протекающих с желтухой, продромальный период длится от 1 до 10 дней и характеризуется появлением симптомов поражения ЖКТ: - боли в области правого подреберья и эпигастральной области, - потеря аппетита, - тошнота; иногда наблюдается повышение температуры, больных беспокоит слабость и кожный чуд. Довольно часто отмечается увеличение печени. Боли характеризуются большей частотой и интенсивностью в отличие от ГА или ГВ. С появлением желтухи явления общей интоксикации не исчезают, как это отмечается при ГА. В типичных, неосложненных слу-чаях, желтушный период длится до 15-21 дня, выздоровление наступает в пределах 1-2 месяцев. Неблагоприятное течение заболевания наблюдается также при суперинфицировании вирусом ГЕ больных хроническим ГВ. В таких случаях летальность может достигнуть 75-80%. Особую актуальность этот факт имеет для регионов с высоким уровнем носительства вируса ГВ. Диагностика Надежных методов диагностики ГЕ в настоящее время нет. Определение уровня билирубина и постановка печеночных энзимных проб не дает возможность отличить ГЕ от ГА или ГВ. В нашей стране разработана иммуноферментная тест-система для обнаружения антигена возбудителя ГЕ в фекалиях. Антиген вируса ГЕ определяется у 10-15% больных уже в первые 7 дней желтушного периода. Пока этот метод не получил широкого применения. Коммерчески, институтом Пастера выпускается иммуно-ферментная система для определения IgG к ВГЕ. В целом ГЕ диагностируется на основании клинической картины острого гепатита при исключении его других этиологических форм - таких, как гепатиты А, В, С, а также гепатитов, вызываемых цитомегаловирусами, вирусом Эпштей-Барр и герпес-вирусом. Гепатит G Открыт в 1995 году, относится к семейству Флавивириде. Представляет собой небольшой (60 нм в диаметре), сложный по строению вирус. Геном представлен одноцепочечной, (+)-РНК. Инфицирование данным вирусом осуществляется парентеральным путем. Относительно клинических проявлений пока еще нет полной ясности. Моноинфекция ГG встречается относительно редко, хотя эта форма может протекать в манифестном и бессимптомном варианте. Микст-инфекция гепатита G с вирусами гепатитов В, С и Д встречается гораздо чаще, чем моноинфекция. TTV (вирус, передающийся при переливании) Открыт в 1997 году. Геном представлен однонитевой –ДНК, имеющей высокую степень вариабильности и подразделяющейся как минимум на 16 геноваров. Вирион имеет сферическую форму диаметром 30-50 нм. Систематическое положение не ясно. Предполагается создать новое семейство вирусов – Цирциновириде и отнести TTV в него. Исследования, проведенные в Японии среди практически здоровых людей выявили в 94% случаев его присутствие.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 466. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |