Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Промышленные адсорбенты. Математическое описание равновесной адсорбции паровСтр 1 из 7Следующая ⇒ Ю.И. Шумяцкий
АДСОРБЦИОННЫЕ ПРОЦЕССЫ
Учебное пособие
Москва, 2005
Предисловие
Учебное пособие предназначено для студентов специальности 251800 «Основные процессы химических производств и химической кибернетики» (специализация 251802 «Мембранные технологии»). В нем описываются процессы очистки и разделения газовых и жидких сред твердыми материалами - адсорбентами, поглощающими молекулы нежелательных веществ. Материал пособия входит в более широкий курс «Сорбционные процессы», который предусматривает изучение, наряду с адсорбционными процессами, процессов ионообменных, основанных на применении веществ, поглощающих ионы,– ионитов. Курс «Сорбционные процессы» и его раздел «Адсорбционные процессы» введен для расширения образовательного базиса студентов и углубления их знаний в области диффузионных явлений и технологий, смежных с мембранной очисткой и разделением газов и жидкостей. Пособие состоит из двух разделов: «Физико-химические и инженерные основы адсорбционных процессов» и «Технология адсорбционных процессов». В области инженерной теории адсорбции и в технологии адсорбционных процессов в последние десятилетия произошли большие изменения. Отражение этих изменений на уровне учебного курса, по мнению автора, представляет большой интерес; оно и было осуществлено в пособии. Материал пособия изложен на познавательном уровне. Как правило, в нем рассматриваются принципиальные вопросы, а именно: с помощью какого процесса можно решить некоторую практическую задачу, какой адсорбент должен быть применен для ее осуществления, какие операции надо провести, чтобы обеспечить достижение поставленной цели ? Это главные вопросы прикладной адсорбции и с ответа на них начинается проектирование  В области технической адсорбции имеется несколько хороших книг. К ним относятся учебное пособие Е.Н.Серпионовой «Промышленная адсорбция газов и паров», М.,1969 и монография Н.В.Кельцева «Основы адсорбционной техники», М., 1984. Автор использовал их в своей работе. Специфика этого пособия состоит в отражении того нового теоретического и прикладного материала, о котором говорилось выше, и в попытке рассмотреть совокупность адсорбционных процессов как некоторое единство взаимосвязанных элементов – процессов.
Автор благодарит заведующего кафедрой «Мембранные технологии», профессора Г.Г.Каграманова, при поддержке которого был введен курс и написано пособие.
1.Физико-химические и инженерные основы адсорбционных процессов
1.1. Основные термины и определения
Адсорбент – твердое тело, используемое в качестве средства очистки (разделения). Адсорбтив (синоним: адсорбат) – вещество, подлежащее удалению для достижения эффекта очистки (разделения). Объемная фаза (синонимы: поток, среда) – среда, подвергаемая очистке (разделению). Она представляет собой жидкость или газ. Адсорбционный процесс заключается в приведении в контакт объемной фазы и адсорбента, в ходе которого нежелательные молекулы объемной фазы поглощаются адсорбентом, а объемная фаза становится чистой. Это краткое описание процесса адсорбционной очистки предполагает, что подвергаемая очистке объемная фаза представляет собой смесь компонентов, один (одни) из которых поглощается лучше, чем другой (другие). Различия в адсорбируемости компонентов вытекают из различий в свойствах, строении и структуре молекул объемной фазы, взаимодействующих с адсорбентом. Свое проявление эти различия находят в адсорбционной емкости (синонимы: адсорбционная активность, величина адсорбции, концентрация адсорбата в адсорбенте), которая характеризует способность единичной массы (объема) адсорбента поглощать компоненты очищаемой среды. В работах академического плана адсорбционную активность выражают в виде числа молей адсорбата, поглощаемых 1 г адсорбента, что соответствует размерности моль/г. В технологических исследованиях чаще используют размерность г/100 г, указывая массу адсорбата, поглощенного 100 г чистого адсорбента. (Часто этот способ выражения адсорбционной емкости называют весовым процентом). Для технологических расчетов самой удобной размерностью емкости является г/м3,т.е. масса поглощенного адсорбата, отнесенная к единице объема адсорбента. Концентрацию вещества в объемной фазе выражают через массу вещества, находящуюся в единице объема среды, г/м3. Другие способы выражения содержания вещества в объемной фазе – это единицы давления, весовая и объемная доли. Обозначим величину адсорбции через Х, концентрацию в объемной фазе – через С. Для предпочтительных размерностей, указанных выше, отношение переменных (К = Х/С) равно формально безразмерной величине, которую будем назвать коэффициентом распределения адсорбата. В системах адсорбент - адсорбат коэффициент распределения зависит от типа системы и условий, в которых она находиться; он лежит в пределах 101- 106 и выше. Отношение коэффициентов распределения двух адсорбатов, находящихся в смеси, называют коэффициентом разделения. Можно показать и это будет сделано в одной из следующих глав, что коэффициенты распределения и разделения можно рассматривать в качестве меры адсорбируемости компонентов, которая возрастает при их увеличении. Если в некоторой системе коэффициенты распределения различаются на порядок и более, то считают, что адсорбция всех компонентов многокомпонентной смеси, кроме адсорбции вещества с наибольшим значением коэффициента распределения (будем далее называть его целевым), пренебрежимо мала. В этом часто встречающемся случае вместо адсорбции многокомпонентной смеси можно рассматривать индивидуальную адсорбцию целевого компонента.
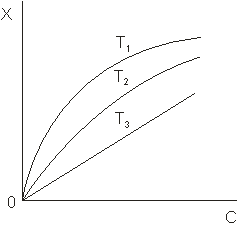
Зависимость равновесной величины индивидуальной адсорбции вещества (целевого компонента) при постоянной температуре от его содержания в объемной фазе называют изотермой адсорбции. Зависимость от температуры при постоянном содержании (парциальном давлении) – изопикной (изобарой) адсорбции. Зависимость равновесного давления от температуры при постоянной величине адсорбции носит название изостеры адсорбции. Поддержание постоянной температуры обеспечивается легче, чем поддержание постоянного содержания в любой из фаз. Поэтому экспериментальный материал по адсорбции обычно получают в виде изотерм. Они же часто являются первичным объектом теоретического анализа. На рис.1.1 приведены типичные изотермы адсорбции. Из рисунка видно, что величина адсорбции (Х) возрастает по мере увеличения концентрации (С) (парциального давления, Р) адсорбата и убывает с ростом температуры (Т).
Рис.1.1.Изотермы адсорбции: T1<T2<T3.
Теоретическая интерпретация изотерм, приведенных на рис.1, для адсорбции на плоской поверхности адсорбента впервые была выполнена американским физиком Ленгмюром и по его имени изотермы такого типа, которые показаны на рисунке, стали называть ленгмюровскими (синоним: выпуклыми). Они очень часто встречаются в адсорбционных системах даже в тех случаях, когда допущения теории Ленгмюра не выполняются или выполняются не полностью. Уравнение Ленгмюра записывается так:
X = XmbC/(1 + bC), (1.1)
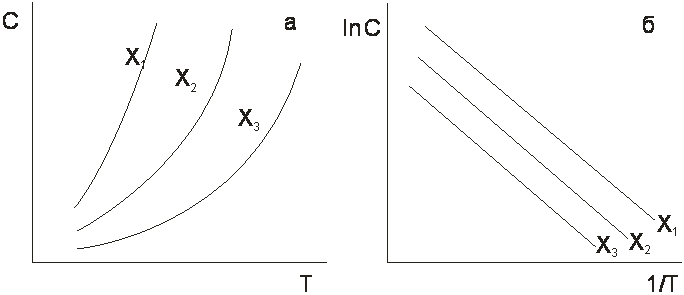
где Xm – предельная величина адсорбции, отвечающая плато на изотерме, b – коэффициент, имеющий смысл константы равновесия. При наличии изотерм адсорбции изопикны - изобары адсорбции получают путем сечения семейства изотерм вертикальными линиями, отвечающими условию С = const. Изостеры адсорбции получают путем сечения изотерм горизонтальными линиями, отвечающими условию: Х = const. Координаты точек пересечения вертикальных прямых с изотермами дают изопикны адсорбции, а пересечения горизонтальных линий с теми же изотермами – изостеры. На рис.1.2 а приведены изостеры адсорбции в координатах С ~ T. На рис.1.2 б эти же изостеры представлены в координатах линейной формы уравнения Клапейрона-Клаузиуса:
LnC ~ - ΔH/RT, (1.2)
где ΔН – теплота адсорбции, кДж/моль; R – газовая постоянная, кДж/моль.К. По тангенсу угла наклона линейных в указанных координатах изостер адсорбции вычисляют изостерическую теплоту адсорбци, т.е. теплоту адсорбции при постоянной величине адсорбции.
Рис.1.2.Изостеры адсорбции: а – в обычных координатах, б – в координатах уравнения Клапейрона - Клаузиуса, X.1>X2>X3.
Одновременное использование изотерм и изостер адсорбции позволяет определить два важнейших свойства системы: величину и теплоту адсорбции. Отметим, что адсорбция – процесс экзотермичный и ее протекание всегда сопровождается выделением тепла.
Промышленные адсорбенты. Математическое описание равновесной адсорбции паров
1.2.1.Природа адсорбции и пористая структура адсорбентов
Все тела, имеющие поверхность – адсорбенты. Адсорбция (задерживание, концентрирование) молекул объемной фазы в твердом теле происходит из-за того, что у молекул поверхности отсутствуют родственные соседи и они взаимодействуют с молекулами сопряженной объемной фазы. Силы молекулярного взаимодействия при адсорбции подобны силам, которыми обусловлена конденсация паров. Они носят название физических, или ван-дер-ваальсовых сил. Различают два типа ван-дер-ваальсовых сил: неспецифические и специфические. Силы первого типа называют также дисперсионными. Их существование и величина связана с молекулярной массой, участвующего во взаимодействии вещества и, чем она выше, тем, как правило, вещество легче конденсируется и сильнее адсорбируется. Специфические силы – это силы электростатической природы. Они проявляются в тех случаях, когда фрагмент поверхности твердого тела и молекулы объемной фаза имеют локально сосредоточенные электрические заряды. Проявления этого вида взаимодействий будут рассмотрены на примере конкретных адсорбентов. Из двух рассмотренных выше видов взаимодействий более сильными, как правило, являются неспецифические (дисперсионные) силы. Ван-дер-ваальсовы силы, конечно, не единственный вид взаимодействия. Кроме них, существуют силы химические. В соответствие с типом сил различают адсорбцию физическую и химическую. В этом пособии мы будем говорить только о физической адсорбции. Она обусловлена сравнительно слабыми силами взаимодействия, и самопроизвольно образовавшуюся адсорбированную фазу легко разрушить, что является одним из условий осуществимости адсорбционного процесса. Итак, все тела, имеющие поверхность, - адсорбенты. Промышленные адсорбенты – это твердые тела имеющие высокоразвитую поверхность. Необходимость развития поверхности для получения высоких величин адсорбции вытекает уже из вида уравнения (1.1). Согласно ему, величина адсорбции (Х) прямо пропорциональна (Хm) – предельной величине адсорбции, которая обусловлена размером поверхности твердого тела. Мерой развитости поверхности является – удельная поверхность, или поверхность, приходящаяся на единицу массы твердого тела (размерность: м2/г), а способом ее развития – придание адсорбенту пористой структуры. Промышленные адсорбенты – это твердые тела с развитой пористой структурой. Непористый кубик с размером ребра 1 см, изготовленный из материала с плотностью 2 г/см3 , имеет удельную поверхность 3.10-4 м2/г. Удельная поверхность промышленного адсорбента часто превышает 103м2/г. Это означает, что определяющий линейный размер пор в твердом теле, который является размером пор, на семь порядков меньше, чем ребро кубика. Он, следовательно, по порядку величин составляет 1 нм. Поры таких и более мелких размеров называют микропорами и мы получили существенное уточнение в определении промышленного адсорбента: это адсорбент, который имеет развитую микропористость. Адсорбция в микропорах имеет ряд отличий от адсорбции на плоской поверхности, Характерные размеры микропор, верхняя граница которых составляет 1 – 1,5 нм, настолько малы, что молекула адсорбата в микропоре находится в некотором специфическом пространстве, в поле сил, образованных стенками поры. Энергия взаимодействия стенок поры и находящейся в ней молекулы, следовательно, велика. Адсорбция происходит при низком содержании адсорбата в объемной фазе. Микропоры адсорбента заполняются полностью, или, как говорят, объемно. Плотность адсорбата в порах, если им является пар, близка к плотности обычной жидкости. Эти особенности адсорбции в микропорах твердого тела учитывает теория объемного заполнения микропор (ТОЗМ), разработанная Дубининым и его школой. В твердом микропористом теле обычно присутствуют микропоры разных размеров и каждая разновидность микропор полностью заполняется при некоторой собственной концентрации (давлении) адсорбата в объемной фазе. Эта особенность придает изотерме адсорбции характер некоторой возрастающей зависимости Х от С (или Р). Закон распределения объема пор адсорбента по их размерам априори не известен, но каждая изотерма адсорбции каждого вещества несет в себе скрытую информацию о нем. Явный характер распределения в работах прикладного плана обычно не выявляют , а используют относительный метод расчета величин адсорбции данного вещества по известным величинам адсорбции некоторого вещества, которое договорились считать стандартным. В качестве стандартного вещества обычно принимают бензол. Способы расчета вытекают из термодинамики. Известно несколько в целом эквивалентных уравнений ТОЗМ. Ниже приведено уравнение Дубинина-Радушкевича, для которого имеется доступный справочный материал:
Х = W0ρa exp{-B(T/β)2(lg Ps/P)2} (1.3).
В этом уравнении: Х – величина адсорбции, г/г; Wo - предельный объем микропор в адсорбенте , см3/г; ρа – плотность адсорбата в адсорбированной фазе, г/см3; B – структурная константа адсорбента, К-2; β – коэффициент аффинности (подобия), Ps и Р - давление насыщенного пара адсорбата при температуре Т (К) и давление пара адсорбата. Рассмотрим смысл параметров и переменных, входящих в уравнение (1.3). Wo и B – структурные характеристики адсорбента. Значения этих параметров приведены в специальной литературе по адсорбции и в каталогах на адсорбенты, ссылки на которые даны в примерах.[А1] Параметр В отражает характер распределения микропор по размерам[А2] , а параметр W0 их суммарный объем. Т и Р – условия опытов, для которых ищут значение [А3] Х. Ps и ρa – физические свойства пара. Давление насыщенного пара определяют по справочным данным для вещества, адсорбцию которого изучают. В определении плотности адсорбата имеется некоторая специфика. При T< Tкип, где Tкип – нормальная температура кипения вещества, плотность адсорбированной фазы полагают равной плотности обычной жидкости. При Ткип <T<Tкр, где Ткр – критическая температура вещества, в расчет принимают экстраполяционное значение плотности. Экстраполяцию проводят по зависимости lg ρa ~ 1/T, определенной в области Т<Ткип. Для температур более высоких, чем критическая температура, т. е. для газов, уравнение (1.3) не используют. Для адсорбции газов применяют другие уравнения равновесной адсорбции. Самым непривычным параметром уравнения (1.3) является коэффициент аффинности. Он учитывает различия в поверхностном натяжении данного адсорбата и адсорбата - стандартного вещества. Его определяют из следующего соотношения: β = П/Пст (1.4), где П и Пст – парахоры данного и стандартного вещества. Парахор – независящий от температуры параметр, устанавливающий связь между поверхностным натяжением (σ), плотностью жидкости и ее пара (ρп). Плотность в данном случае имеют размерность моль/см3. Парахор равен: П = σ 0,25/(ρа – ρ п). Важной особенностью парахора является то, что он может быть рассчитан из структуры молекулы по аддитивной схеме. Последнее означает, что парахор молекулы равен сумме ингредиентов парахоров входящих в нее атомов, связей и структурных элементов (колец). Эти ингредиенты приведены в справочной литературе. Есть две системы ингредиентов парахора. В ТОЗМ используют ингредиенты парахоров по Сегдену. Порядок вычисления парахора объясним на примере. Определим парахор молекулы бензола. Она содержит 6 атомов углерода, 6 атомов водорода, 3 двойных связи и 1 бензольное кольцо. Ингредиенты парахора этих элементов, согласно справочнику (см. в примере) , таковы: углерод 4,8, водород 17,1, двойная связь 23,2, шестичленное кольцо 6,1. Отсюда парахор бензола равен:
Пс6н6 = 6.4,8 + 6.17,1 + 3.23,1 + 1.6,1 = 28,8 + 102,6 + 69,6 + 6,1 = 207,1.
Вычислив парахоры двух веществ, одно из которых стандартное, по уравнению (1.4) находят коэффициент аффинности. Таким образом, коэффициент аффинности стандартного вещества равен единице. При всей сложности своей структуры уравнение (1.3) описывает ту же выпуклую («ленгмюровскую») изотерму адсорбции, для которой было записано уравнение (1.1). Однако между этими двумя формально родственными уравнениями имеются принципиальные различия. Они описывают разные ситуации: одно адсорбцию на поверхности непористого адсорбента, другое адсорбцию в микропорах адсорбента с развитой пористостью – промышленного адсорбента. Эмпирические коэффициенты Wo и B уравнения (1.3) определены для огромного количества адсорбентов и не зависят от вида адсорбата и условий опыта. Эмпирические коэффициенты уравнения (1.1), как правило, не известны; они изменяются при переходе от системы к системе и зависят от температуры. Кроме массы и наличия заряженных фрагментов поверхности, молекулы адсорбатов характеризуются размерами. В молекулярно-кинетической теории оценкой размера молекулы является минимальное расстояние, на которое могут сблизиться две одинаковые молекулы. Его называют кинетическим диаметром молекулы. Синонимом этого понятия в адсорбции является критический диаметр молекулы. Сведения о кинетических, или критических размерах молекул приведены в специальной литературе по адсорбции. Если размер некоторых пор адсорбента меньше, чем критический размер молекул адсорбата, то, очевидно, в эти поры эти молекулы проникнуть не смогут и адсорбироваться в них не будут. Отсюда следует важный вывод. Если в некотором адсорбенте присутствуют поры только одного размера, то такой адсорбент будет поглощать молекулы веществ, критические диаметры которых не превысят размер пор. Такой адсорбент называют однороднопористым и он обладает свойствами молекулярного сита. Эффект разделения веществ, основанный на различиях в размерах адсорбирующихся молекул, носит название молекулярно-ситового эффекта. Приведем примеры. Молекулы азота и кислорода имеют критические размеры соответственно 0,37 и 0,34 нм. Однороднопористый адсорбент, поры которого имеют номинальный диаметр 0,36 нм, способен поглощать кислород и не поглощает азот. Молекулы нормальных и изо-углеводородов парафинового ряда имеют критические размеры 0,49 и 0,56 нм. Однороднопористый адсорбент с размером пор около 0,5 нм будет разделять смесь этих углеводородов. Итак, молекулярно-ситовой эффект является еще одним средством разделения смесей, в состав которых входят вещества с молекулами, различающихся размеров. В ходе синтеза адсорбентов в их структуре возникают поры, размеры которых превышают верхнюю границу (1-1,5 нм) размера микропор. Образование таких пор рассматривают как положительный фактор, так как поры значительного размера облегчают миграцию адсорбирующихся молекул внутри структуры адсорбентов. Их называют транспортными порами. Выделяют две разновидности транспортных пор: мезопоры и макропоры. Условной границей, разделяющей их, считают 100-200 нм. Существование границы связано с тем, что в мезопорах, в отличие от макропор, возможно протекание капиллярной конденсации. Мы не будем рассматривать это интересное и непростое явление, так как оно происходит в условиях, когда адсорбция в сущности уже завершилась. Отметим, что из-за сравнительно крупного размера мезо- и макропор, их удельная поверхность невысока и они не способны адсорбировать вещества с небольшой молекулярной массой в количествах, соизмеримых с адсорбцией этих веществ в микропорх. Мезопористые адсорбенты применяют для поглощения высокомолекулярных соединений, полимеров и даже вирусов.
1.2.2.Краткие сведения об адсорбентах
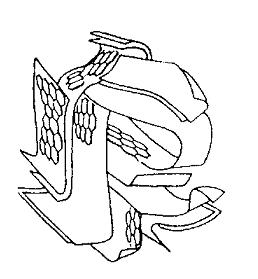
Номенклатура промышленных адсорбентов достаточна велика. Ниже мы приводим данные для трех адсорбентов, которые чаще других используются в промышленной практике: активных углей, силикагелей и цеолитов. Активные угли. Современная технология производства активных углей базируется на разработках германского углехимика Острейко, выполненных в начале 20 в. Уголь получают из углеродсодержащего сырья растительного (древесина, торф, ископаемые угли, скорлупа орехов и др.) или искусственного (полимерные смолы) происхождения. Синтез включает две операции. Первая из них носит название карбонизации, вторая – активации. На первой стадии в ходе термообработки образуется адсорбент пористой структуры. На второй из образовавшихся пор удаляют аморфный углерод и смолы. Для этого адсорбент подвергают термообработке в газовой среде или обработке химическими реагентами. Частицы пористого углерода дробят и используют в виде порошкообразного угля. Для получения гранулированного адсорбента угольный порошок смешивают со связующим веществом – каменноугольной смолой, формуют и сушат. Диаметр гранул активных углей в зависимости от направления использования лежит в интервале 1-5 мм. Активный уголь широко применяют в пищевой промышленности, при очистке питьевой воды, в газоочистке, в медицине и фармацевтике, в технологических процессах. В последние годы его стали использовать для рекультивации пахотных земель. Те направления применения активных углей, которые будут рассмотрены ниже, относятся к водоподготовке- и газоочистке. На их долю приходится от 15 до 40 % от общего объема производимых активных углей. Структуру активных углей называют турбостратной – закрученной. В ее основе лежит графитовая структура, в которой плоские слои шестичленных углеродных колец сдвинуты и повернуты относительно друг друга. Структуру активного угля часто уподобляют «пучку мятых лент» или «клочку мятой бумаги». Модели этих структур изображены на рис.1.3. Пористая структура активных углей содержит все три разновидности пор: микро-, мезо- и макро-. Микропоры трубчатой и щелевидной конфигураций сосредоточены в виде зон микропористости размером 10-60 нм. Между зонами проходят мезо- и макропоры. Количество пор каждого типа зависит от марки угля и в виде удельной характеристики (например, «объем микропор», см3/г) приведено в специальных справочниках. В них же указаны параметры уравнений ТОЗМ: Wo и B.
а б
Рис.1.3. Модели структур активного угля: а – «пучок мятых лент» (поперечное сечение), б – «комок мятой бумаги»
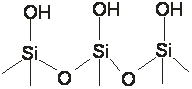
На поверхности активных углей обнаружено большое количество функциональных групп: фенольная, карбонильная, карбоксильная, эфирная, энольная, лактоновая. В состав шестичленных колец часто входят гетероатомы: азот, сера. Эти особенности поверхности активных углей часто определяют их ионообменную и каталитическую активность. Но в адсорбционных приложениях активный уголь обычно рассматривают как аполярный материал, способный только к дисперсионному взаимодействию с молекулами адсорбатов. Для качественной оценки характера поверхности мы будем использовать данные об адсорбции трех молекул: этана, этилена и пропана. Этан и пропан - аполярные молекулы. Этилен имеет двойную связь и, следовательно, содержит π-электроны, но при адсорбции на активном угле эта особенность молекулы этилена не проявляется и вещества адсорбируются в порядке возрастания молекулярной массы: этилен < этан < пропан. Этот тест и является свидетельством слабой склонности углей к специфическим взаимодействиям. В последние годы осуществлен промышленный выпуск молекулярно-ситовых активных углей. Они имеют однородно пористую структуру с порами условного размера 0,4 и 0,5 нм. Таким образом, очистку и разделение сред на активных углях возможно осуществить по двум особенностям молекул адсорбтивов: на основании различий в массе и в размерах. В наименованиях торговых марок активных углей, в отличие от наименований других промышленных адсорбентов, упорядоченность отсутствует. Иногда их называют по области применения, например, АР – активный рекуперационный. Иногда по типу использованного сырья и методу получения, например, СКТ – торфяной сульфидно-калиевой активации. Иногда по веществу – активатору. Иногда название угля содержит аббревиатуру, соответствующую фамилии, имени и отчеству автора. В каталогах угли расположены по типу очищаемой среды (угли для очистки газовых сред, угли для очистки жидких сред) и по назначению. Внутри этих разделов угли ранжированы по форме частиц: гранулированные, дробленные, порошкообразные. Описание каждой марки угля содержит указания на предпочтительную область применения и техническую характеристику, в которую, в числе прочих важных сведений, входят данные о содержании пор каждой группы и коэффициентах уравнений ТОЗМ. Эти коэффициенты определены по стандартному веществу – бензолу. Силикагели.Синтез адсорбентов этого типа впервые был осуществлен в 20-х г.г. 20 в. американским химиком Люисом. Силикагель получают при взаимодействии солей поликремниевых кислот с минеральными кислотами. В ходе синтеза образуется аморфный гидратированный кремнезем, последующие превращения которого идут с отщеплением воды по механизму поликонденсации. Процесс поликонденсации приводит к образованию частиц коллоидных размеров – глобул. Слипшиеся глобулы формуют в минеральном масле в гранулы. Первые стадии этого процесса схематично могут быть описаны следующими уравнениями: Na4SiO4 + H2SO4 = Si(OH)4 +2Na2SO4 2Si(OH)4 = (OH)3Si-О-Si(OH)3 + H2O и т.п. Размеры глобул (2-30 нм) определяются условиями синтеза и в свою очередь задают характер пористой гранулы структуры адсорбента. На рис.1.4 приведены модели двух глобулярных структур, отвечающих мелкопорисиому (рис.1.4 а) и крупнопористому (рис.1.4 б) силикагелям.
а б
Рис.1.4. Модели глобулярной структуры мелкопористого (а) и крупнопористого (б) силикагелей.
Обычную для адсорбции классификацию пор по размерам (микро-, мезо-, макро-) для силикагелей не используют. Ее непригодность видна даже из схематичных изображений, приведенных на рис.1.4. В силикагелях нет других пор, кроме пространств переменного размера между глобулами, размеры которых определяют размеры пространств. По величине глобул силикагели подразделяют на мелко-, средне- и крупнопористые. Поверхность глобул, обращенная внутрь межглобулярного пространства, содержит кислые гидроксилы: - ОН+. Модель поверхности силикагеля может быть представлена схемой, приведенной на рис. 1.5.
Рис.1.5. Модель поверхности силикагеля.
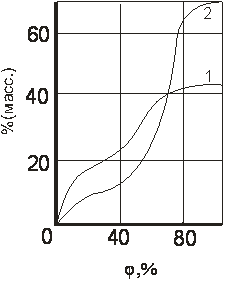
Поверхность силикагеля, таким образом, несет положительный заряд и способна к специфическим (электростатическим) взаимодействия. В триаде этан, этилен и пропан отрицательный заряд имеется только у этилена, и молекулы этого вещества адсорбируются на силикагеле лучше, чем аполярные молекулы этана, но хуже чем пропана. Ряд адсорбируемости для силикагеля имеет вид: этан < этилен < пропан. Силикагель используют для осушки газов, очистки минеральных масел и как носитель катализаторов. Для нас главной областью его применения будет являться осушка – удаление паров воды из газов. Хорошие уравнения для описания равновесной адсорбции воды на силикагелях отсутствуют и в технологических расчетах используется прямая экспериментальная информация. Пример ее приведен на рис.1.6., на котором представлены изотермы адсорбции воды на двух образцах силикагелей.
Рис.1.6. Изотермы адсорбции воды на мелкопористом (2) и среднепористом (1) силикагелях при 20 0С.
Изотермы, приведенные на рисунке, имеют неленгмюровский характер, что связано с протеканием в порах силикагеля капиллярной конденсации. Промышленные марки силикаглей обозначают комбинацией из четырех букв. Вторая буква слева всегда С, что означает силикагель. Первая литера говорит о размере частиц силикагеля: К – крупный, М – мелкий, Ш – шихта (смесь крупного и мелкого) Третья буква характеризует пористую структуру адсорбента: М – мелкопористый, С – среднепористый, К – крупнопористый. Четвертую букву в наименовании силикагеля часто пропускают, но, если она есть, то ею обозначена форму частиц адсорбента. Итак, КСМГ означает крупный силикагель мелкопористый гранулированный, а ШСК – шихта силикагель крупнопористый. Цеолиты. Цеолиты встречаются в природе и известны очень давно. Промышленный синтез цеолитов был осуществлен в конце 40-х г.г. 20 в. Он связан с именем английского физико-химика Баррера. Цеолиты – химические соединения. Они представляют собой алюмо-силикаты ионов щелочных и щелочноземельных металлов. Химическая формула натриевого цеолита записывается так:
Na2O.Al2O3. nSiO 2 .mH2O
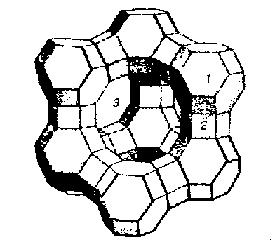
Мольное отношение оксида натрия к оксиду алюминия в цеолите всегда равно единице. Отношение оксида кремния к оксиду алюминия (m) носит название кремнеземового модуля и может изменяться в очень широких пределах. Значение этого модуля определяет кристаллографический тип цеолита и многие его свойства. В адсорбции используют цеолиты с низким значением кремнеземового модуля. Оно определяет сравнительно высокую концентрацию ионов Na+, которые являются преимущественным местом сорбции в структуре цеолитов. На рис. 1.7. представлена модель структуры одного из цеолитов – адсорбентов.
Рис.1.7. Модель структуры цеолита типа Х.
Как видно из рисунка, цеолиты имеют жесткую упорядоченную трехмерную решетку. Ее образует чередование атомов алюминия и кремния, соединенных друг с другом кислородными мостиками. Главным структурообразующим элементом решетки являются кубооктаэдры 1, в вершинах которого расположены кремний или алюминий. Ребра кубооктаэдров и призм 2 – это условные изображения связей. соединяющих атомы отдельных кубооктаэдров. Составленная из кубооктаэдров решетка цеолита ажурна. В ней находятся полости 3, которые в исходном цеолите заполнены водой. После нагрева цеолита и удаления воды полости освобождаются и становятся пригодными для адсорбции многих молекул. В полостях и «окнах» цеолитов находятся положительно заряженные ионы натрия, которые компенсируют в целом отрицательный заряд решетки. Они обладают подвижностью и могут быть замещены ионами других металлов. Натрий и замещающие его ионы называют обменными катионами цеолита. Диаметр полостей цеолитов и «окон», соединяющих полости, специфичны для цеолита каждого типа. (Они, следовательно, зависят от значения кремнеземового модуля). В цеолите типа Х, модель структуры которого приведена на рис. 1.7., полости и «окна» имеют диаметр соответственно 1,1 и 0,9 нм. Кристаллы цеолитов – типичные микропористые и, более того, однородно пористые адсорбенты – молекулярные сита. Сырьем для получения натриевых цеолитов служат алюминат натрия, силикат- глыба и вода. Смесь компонентов гомогенизируют и выдерживают в автоклаве при температурах, близких к 100 0С. Из реакционной смеси с течением времени кристаллизуются и формируются кристаллы цеолита. Их отделяют от маточного раствора, смешивают со связующим (глиной) и формуют в гранулы размером 1-5 мм. Гранулы прокаливают для придания глине прочностных свойств. Зазоры между частицами глины и кристаллами цеолита образуют транспортные поры: мезо- и макро-. В технике получения и использования цеолитов по отношению к ним применяется специальный термин - вторичные поры. Певичными же считают микропоры, входящие в структуру самого цеолита. Вторичные поры, как правило, оказывают пренебрежимо малое влияние на адсорбционные, в том числе молекулярно-ситовые, свойства цеолитов. Центром сорбции в цеолитах, как уже говорилось, является ионы натрия и другие обменные катионы. Молекулы адсорбатов взаимодействуют с ним по неспецифическому механизму, если они аполярны, или смешанному неспецифическому – специфическому, если они заряжены. В триаде этилен, этан, пропан проявляются оба вида взаимодействий: пропан адсорбируется лучше этана, потому что больше его молекулярный вес, а этилен адсорбируется лучше и этана, и даже пропана, потому что он имеет π-электроны, взаимодействующие с положительно заряженным ионом натрия. Ряд адсорбируемости будет таким: этан < пропан < этилен. Кроме катион-электронного взаимодействия при адсорбции на цеолитах проявляются катион-дипольное и катион-квадрупольное взаимодействия. Первое из этих двух взаимодействий присуще, например, воде и цеолиты являются наилучшим веществом – осушителем. Квадрупольный момент в известном приближении можно рассматривать как элемент топографии поверхности молекул, который проявляется в наличии на участках поверхности электрических зарядов. Хорошим наглядным представлением о квадруполе дает наличие двух антипараллельных диполей в одной молекуле. Антипараллельными называют. такие диполи, которые расположены друг рядом с другом и параллельно друг с другом, но на концах которых находятся разные заряды. (Диполи – вещества, обладающие дипольным моментом, не имеют момента квадрупольного). Квадруполями являются молекулы диоксида углерода и азота и эти вещества, слабо адсорбирующиеся на всех других адсорбентах, цеолитами поглощаются как адсорбаты со средней адсорбируемостью. Обычно цеолиты синтезируют в натриевой форме. Но натрий, как указывалось, в ходе ионного обмена может быть замещен на ион любого элемента первой и второй групп периодической системы элементов Д.И.Менделеева. Обмен идет в соответствии с обычными правилами электронейтральности. (Например, два иона Na+ замещаются на один ион Ca2+). Замещение натрия другими ионами не приводит к изменению кристаллографического типа цеолита, но из-за различий в размерах и числе катионов происходит изменение молекулярно-ситовых свойств цеолитов. Цеолиты, таким образом, способны разделять смеси молекул по различиям в их массе, распределению зарядов и размерам. Для описания адсорбции на цеолитах применяют уравнения ТОЗМ. Параметры уравнений Wo, B и β приведены в специальной литературе. Коэффициент аффинности (β) из-за проявления специфических сил, не учитываемых в отношении парахоров, рассчитывают только для аполярных веществ. Для полярных и квадрупольных веществ используют экспериментальные значения коэффициентов аффинности. Стандартным веществом часто является азот. При адсорбции, как правило, применяют цеолиты трех кристаллографических типов: А, Х и М. Они различаются в первую очередь значением кремнеземового модуля, средние значения которого равны: mA = 2, mX = 2.5, mM = 9-10. В натриевом цеолите А диаметр входных окон, ведущих во внутренние полости, составляет 0,4 нм, в цеолите Х – 0,8–0,9 нм, в цеолите М ~ 0,6 нм. Цеолиты А и Х, благодаря низкому значению кремнеземового модуля, содержат сравнительно большое количество обменных катионов и поэтому они хорошие адсорбенты. Цеолит М с высоким значением модуля – менее эффективный адсорбент, но он кислотостоек. Российская система классификации цеолитов содержит два элемента: тип обменного катиона и кристаллографический тип цеолита: NaA – натриевый цеолит типа А. Западная система также содержит два элемента: диаметр входных окон (в Ǻ, ангстремах) и кристаллографический тип. Например: 4А – цеолит типа А с диаметром входных окон 0,4 нм. В табл.1.1. перечислены самые распространенные типы цеолитов и указаны базовые области их применения.
На примере трех адсорбентов (углей, силикагелей и цеолитов) обсудим первичные принципы выбора типа адсорбента для реализации некоторого конкретного процесса. Пусть мы имеем смесь двух молекул А и В, которые отличаются одним из указанных выше свойств: молекулярной массой, Зарядом поверхности молекулы или ее размером. Уже при постановке задачи известно, какое вещество нужно получить в чистом виде, а какое удалить. Для определенности будем считать, что удалению подлежит вещество А. Следовательно, из совокупности свойств, характеризующих компоненты
Таблица 1.1
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 402. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |