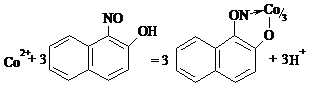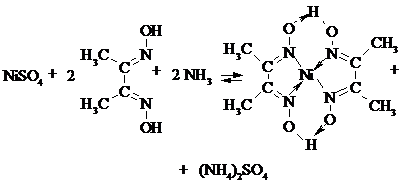Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Дослід 25. Реакція з реактивом Ільїнського.1-нітрозо-2-гідроксинафталін з кобальтом в залежності від концентрації металу розчин забарвлюється в червоний колір або випадає червоно-бурий осад:
Виконання досліду. У пробірку поміщають 4-5 краплин розчину солі кобальту, добавляють 3-4 краплі розчину HCl і нагрівають до кипіння, додають свіжо приготовлений насичений розчин 1-нітрозо-2-гідроксинафталіну і знову нагрівають. У присутності кобальту, залежно від концентрації, розчин забарвлюється в червоний колір або випадає червоно-бурий осад.
Чутливість реакції складає 0,05 мкг.
Реакції виявлення іона Ni2+ Дослід 26. Реакція з лугами або амоній гідроксидом.Луги (NaОH або КОH) осаджують іони Ni2+ у вигляді зеленого осаду гідроксиду нікелю (ІІ): NiSO4 + 2NaОH = Ni(OH)2↓ + Na2SO4. Осад Ni(OH)2 розчиняється в кислотах. Розчин амоній гідроксиду осаджує з водних розчинів солей ніколу (ІІ) зелений осад основної солі, який розчиняється в надлишку реактиву з утворенням комплексної сполуки інтенсивно синього забарвлення: 2NiSO4 + 2NH4ОН = (NiOH)2SO4↓ + (NH4)2SO4; (NiOH)2SO4 + (NH4)2SO4 + 10NH4ОН = 2[Ni(NH3)6]SO4 + 12H2О. Виконання досліду. У дві пробіркидодають по 3 - 4 краплі розчину солі NiSO4. До однієї пробірки додають розчин NaОH. До утвореного зеленого осаду Ni(OH)2 додають 5-7 крапель НCl і спостерігають за зникненням осаду. До другої пробірки додають поступово розчин NH4ОН. Спостерігають, як зелений осад основної солі (NiOH)2SO4 розчиняється в надлишку NH4ОН з утворенням розчинної комплексної сполуки [Ni(NH3)6]SO4 синього кольору. Дослід 27. Реакція з реактивом Чугаєва.Диметилгліоксим (реактив Чугаєва)в розчині амоній гідроксиду утворює з йонами Ni2+ xeлатну сполуку нікол диметилгліоксимату яскраво-червоного кольору: 
Реакція характеризується високою чутливістю (0,16 мкг), однак іони Fe2+ і Cu2t перешкоджають визначенню. В присутності солей амонію NH4OH не осаджує іон Ni2+. Виконання досліду. Цю реакцію можна виконувати краплинним методом. Для цього на смужку фільтрувального паперу наносять краплю солі ніколу (ІІ), добавляють дві краплі концентрованого розчину амоній гідроксиду і краплю реактиву. Спостерігають появу на папері червоної плями. |
||
|
Последнее изменение этой страницы: 2018-04-11; просмотров: 471. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |