
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Электролитическая диссоциация кислот, щелочей и солейДиссоциация кислот: Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H +). Диссоциация щелочей: Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH -). Диссоциация солей: Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH+4) и анионы кислотных остатков.
Степенью диссоциации (d) - электролита называется отношение числа его молекул, распавшихся на ионы, к общему числу молекул электролита в растворе.
Константа электролитической диссоциации (Кд)- характеризует способность данного электролита в среде данного растворителя распадаться на ионы. Чем выше ее значение, тем больше концентрация ионов в сравнении с концентрацией не распавшихся на ионы молекул электролита. Активность(a) – это эффективная или действующая концентрация раствора с учётом различных взаимодействий между ними в растворе, то есть с учётом отклонения поведения системы от модели идеального раствора.
Коэффициент активности- отношение активности к общей концентрации вещества в растворе. Коэффициент активности служит мерой отклонения поведения раствора (или компонента раствора) от идеального.
Ионное произведением воды (Кв) –это произведение концентраций ионов H+ и ОН– при данной температуре есть величина постоянная
Водородный показатель (рН)— величина, характеризующая активность или концентрацию ионов водорода в растворах. В нейтральной среде рН = 7, в щелочной среде рН > 7, в кислой среде рН < 7. 
Показатель основности раствора (pOH)- равная отрицательному десятичному логарифму концентрации в растворе ионов OH−
Произведение растворимости (ПР) -произведение концентраций его ионов, возведённых в степень их стехиометрических коэффициентов, есть величина постоянная при данной температуре в насыщенном растворе малорастворимого электролита. При AmBn mА+ + nВ–,
Условие растворения осадка. Произведение концентраций ионов, возведённых в степень стехиометрических коэффициентов, должно быть меньше величины произведения растворимости
Условие образования осадка.Произведение концентраций ионов, возведённых в степень стехиометрических коэффициентов, должна быть больше величины произведения растворимости
Необратимые реакции : Если в результате взаимодействия ионов образуются · малорастворимые электролиты, выпадающие в осадок, · газы, · растворимые слабые электролиты, · комплексные ионы, то такие реакции практически идут до конца . Необратимые реакции сопровождаются уменьшением энергии Гиббса. Обратимые реакции: Реакции, в которых хотя бы одно из исходных и конечных веществ – растворимый слабый электролит или малорастворимый электролит в виде осадка. Равновесие этих реакций смещено в сторону образования более слабого (с меньшей Кд) или менее растворимого (с меньшим ПР) электролита.
Условия смещения ионных равновесий: реакции в растворах электролитов всегда идут в сторону образования наименее диссоциированных или наименее растворимых веществ.
4. Коррозия и защита металлов. Коррозия и защита металлов.Формирование электродного потенциала металла. Двойной электрический слой (ДЭС). Ряд напряжений металлов. Кинетическое описание коррозионных процессов. Классификации видов коррозии. Химическая коррозия. Защитные плёнки. Факторы, определяющие скорость газовой коррозии. Электрохимическая коррозия: анодные, катодные процессы. Коррозия с кислородной и водородной деполяризацией. Основные направления борьбы с коррозией: воздействие на коррозионную среду, на конструкционные особенности изделия, легирование, покрытия (органические, неорганические, металлические), электрохимическая защита металлов (анодная, катодная).
|
||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 700. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

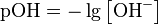
 .
.
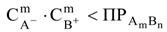 .
. .
.