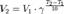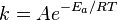Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Влияние катализаторов на скорость реакции.Стр 1 из 7Следующая ⇒ Первый закон термодинамики Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
Энтальпия - это тепловой эффект реакции, измеренный (или вычисленный) для случая, когда реакция происходит в открытом сосуде (т.е. при неизменном давлении). Обозначается как ΔH. Стандартная энтальпия образования простых веществ и химических соединений-энтальпия при стандартных условиях Т-289К P=1,013*103 Па µ=1 моль Следствие из Закона Гесса Тепловой эффект реакции равен сумме энтальпии образования продуктов минус энтальпии образования исходных веществ с учетом стехиометрических коэффициентов. aA+bB=cC+dD ΔH=cΔH(C)+dΔH(D)-aΔH(A)-bΔH(B) Энтропия –это мера беспорядка системы, состоящая из многих элементов. Второй закон термодинамики: все самопроизвольные процессы в замкнутой неравновесной системе происходят в таком направлении, при котором энтропия системы возрастает; в состоянии теплового равновесия она максимальна и постоянна.
Изменение энтропии в физико-химических процессах. ΔS=S2-S1 Условия самопроизвольного протекания химической реакции
Энергия Гиббса Энергия Гиббса характеризует максимальную полезную работу, совершаемой системой. Если в ходе реакции: ΔG=0 (система находится в состоянии равновесия)  ΔG>0 (в прямом направлении реакции невозможны, протекает только в обратном) ΔG<0 (реакция может протекать самопроизвольно)
Способы расчета ΔG реакции · По уравнению Гиббса
2) По следствию из закона Гесса ΔGреак.= ΔGпр. – ΔGисх.
Влияние катализаторов на скорость реакции. Катализатор – это вещество, изменяющее скорость химической реакции, но само в реакции не расходуется и в конечные продукты не входит. При этом изменение скорости реакции происходит за счет изменения энергии активации, причем катализатор с реагентами образует активированный комплекс. Катализ -химическое явление, суть которого заключается в изменении скоростей химических реакций при действии некоторых веществ (их называют катализаторами). Гетерогенный катализ - реагент и катализатор находятся в разных фазах - газообразной и твердой. Гомогенный катализе -реагенты (реактивы) и катализатор находятся в одной фазе - например, оба являются газами или оба растворены в каком-либо растворителе . |
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 481. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |