Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
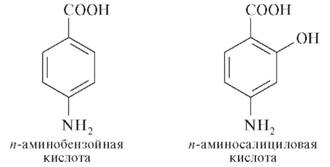
Механизм действия и биотрансформация.Натрия пара-аминосалицилат оказывает бактериостатическое действие на микобактерии туберкулеза. ПАСК в форме натриевой соли активна только в отношении M. tuberculosis и не действует на другие микобактерии. В основе туберкулостатического действия ПАСК и ПАСК Na лежит конкурентный антагонизм с ПАБК, являющейся фактором роста M. tuberculosis:
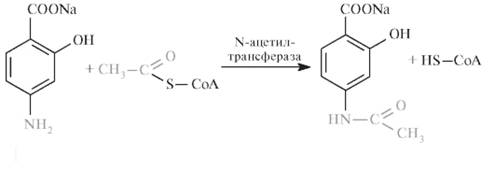
Структурные изомеры ПАСК, у которых - NH2-группа находится в мета- или орто-положении, не могут составлять конкуренцию ПАБК в образовании фолатов и являются неактивными. ПАСК действует на микобактерии, находящиеся в состоянии активного размножения, и практически не действует на микобактерии в стадии покоя. В связи с невысокой активностью ПАСК применять ЛС необходимо только в комбинации с другими, более активными препаратами. Ввиду присутствия в структуре ПАСК полярных функциональных групп (- COOH, - OH, - NH2) метаболические превращения минуют стадию функционализации, цель которой заключается в перестройке молекулы ксенобиотика в более полярный метаболит, и подвергаются фазе конъюгации посредством реакции N-ацетилирования ацетилкоферментом А. В результате происходит детоксикация и образуются фармакологически неактивные метаболиты:
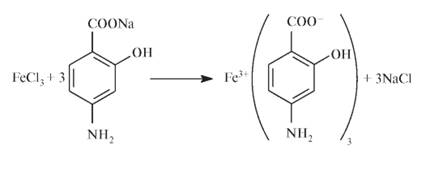
ПАСК Na ацетилкофермент А ацетилированный метаболит Скорость ацетилирования ПАСК зависит от содержания лекарственного вещества в крови и дозы: чем больше однократная доза, тем меньшая доля ПАСК ацетилируется. При больших дозах быстро достигается предел ацетилирования и в печени метаболизируется не более 20% ПАСК. В крови и тканях создается более высокая концентрация лекарственного вещества не только за счет большей дозы, но и вследствие снижения скорости ацетилирования. В связи с этим целесообразно однократное введение большой дозы препаратов ПАСК (при отсутствии видимых противопоказаний к их применению).  Контроль качества Определение подлинности.Подлинность ПАСК Na определяют как химическими, так и физико-химическими методами - например, сравнивая полученный ИК-спектр испытуемой фармацевтической субстанции ПАСК Na со спектром стандартного образца натрия я-аминосалицилата дигидрата. Водный 0,001% раствор ПАСК Na поглощает в УФ-области и имеет два максимума: при 265 и 299 нм. рН 2% водного раствора ПАСК Na - 6,5-8,5. От прибавления к 2% водному раствору ПАСК Na 0,1 мл железа (III) хлорида появляется красно-коричневое окрашивание. Реакция основана на образовании окрашенного аминосалицилата:
аминосалицилат Водный раствор ПАСК Na дает характерную реакцию на первичные ароматические амины - получение азокрасителя краснооранжевого цвета. Отличить я-аминосалициловую кислоту и ее натриевую соль можно по их различной растворимости в полярных растворителях, а также по положительным реакциям на ион натрия: окрашивание бесцветного пламени горелки в желтый цвет и реакций на ион Na+ (см. приложение 4). Испытания на чистоту.В фармацевтической субстанции ПАСК Na контролируют родственные примеси (А, В) методом жидкостной хроматографии.
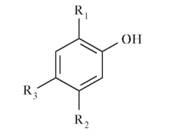
• А. R1=R3=H, R2=NH2: 3-аминофенол. • В. R1=C02H, R2=H, R3=NH2: 5-амино-2-гидроксибензойная кислота. 3-Аминофенол - промежуточный продукт синтеза и-аминосалицилата; 5-амино-2-гидроксибензойная кислота - неактивный мета-изомер ПАСК. Кроме того, в субстанции определяют тяжелые металлы (не более 10 мкг/кг Pb). Потеря массы при высушивании не должна превышать 16,0- 17,5% в пересчете на 1 г субстанции. Пирогенность оценивают по реакции на кроликах с учетом введенной дозы - 10 мл 20 мг/мл раствора субстанции, приготовленного на воде для инъекций, на килограмм массы кролика. Количественное определение.Количественное определение n-аминосалицилата натрия проводят методом нитритометрии с потенциометрической индикацией. Для этого высушенную до постоянной массы навеску ЛВ (около 0,150 г) растворяют в 20 мл воды, прибавляют 10 мл 500 г/л раствора натрия бромида и 25 мл ледяной уксусной кислоты. Затем прибавляют 5 мл 0,1 моль/л раствора натрия нитрита и немедленно продолжают титровать тем же раствором до точки эквивалентности. 1 мл 0,1 моль/л раствора натрия нитрита соответствует 17,52 мг C7H6NNaO3. Контрольные вопросы и задания • Объясните историческую необходимость в поиске новых местноанестезирующих лекарственных средств. Какие побочные действия развивались при приеме природного местного анестетика - кокаина? • Изобразите общую структурную формулу сложных эфиров ПАБК. Что общего и в чем отличие местных анестетиков друг от друга? Охарактеризуйте их кислотно-основные и окислительно-восстановительные свойства. • Назовите отличия физико-химических свойств местных анестетиков. Чем объясняется невозможность изготовления жидких гомогенных лекарственных форм бензокаина? • Поясните механизм действия сложных эфиров ПАБК. Каковы пути их биотрансформации? • Напишите реакции получения бензокаина, прокаина. Предложите схему реакции получения тетракаина гидрохлорида. • Дайте характеристику УФ-спектрам поглощения прокаина гидрохлорида и тетракаина гидрохлорида. Сравните их спектральные характеристики. • Назовите общие и специфические реакции для сложных эфиров ПАБК. Напишите уравнения химических реакций. • Перечислите методы количественного определения местных анестетиков. Чем отличаются методы, предлагаемые для определения бензокаина от методов определения прокаина и тетракаина гидрохлоридов? • Напишите уравнения реакций количественного определения местных анестетиков различными способами, рассчитайте титры соответствия. • Объясните особенные требования к хранению тетракаина гидрохлорида. Почему материалы, контактирующие с ЛВ, не должны содержать остатков щелочи? • Дайте характеристику кислотно-основным свойствам п-аминосалициловой кислоте и ее натриевой соли. Почему в медицине применяется преимущественно ПАСК Na? • Опишите механизм действия ПАСК. Почему структурные изомеры ПАСК не обладают туберкулостатическим действием? • Напишите реакцию биотрансформации ПАСК Na. Почему минуется фаза I биотрансформации? • Перечислите основные этапы промышленного синтеза ПАСК и ПАСК Na. Напишите соответствующие уравнения реакций. • Напишите реакцию взаимодействия ПАСК Na с железа(Ш) хлоридом. От чего зависит окраска образующегося соединения? • Какие типы красителей может образовать п-аминосалицилат? Напишите реакции их получения. • Как можно отличить я-аминосалициловую кислоту от ее натриевой соли? Приведите примеры. • Какие примеси допускает НД в фармацевтической субстанции ПАСК Na? Назовите источники примесей. • Обоснуйте методику количественного определения ПАСК Na в соответствии с ЕФ. Напишите уравнения реакций. Рассчитайте титр соответствия. Какими способами еще можно зафиксировать конец нитритометрического титрования ПАСК Na? • Решите задачу. Рассчитайте теоретический объем титранта 0,1 моль/л раствора натрия нитрита, который израсходуется на титрование 0,1548 г навески субстанции ПАСК Na, высушенной до постоянной массы (Mr 211,2).
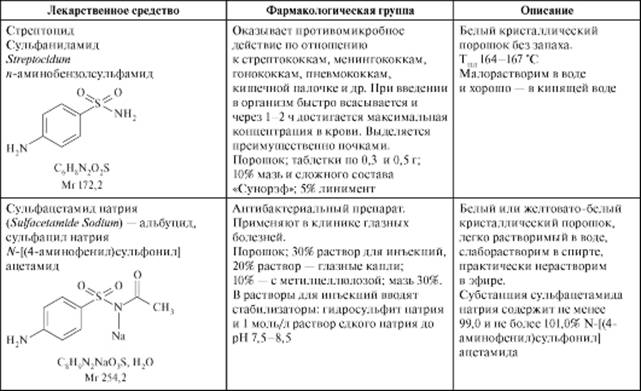
Сульфаниламиды ЛС сульфаниламиды - аминопроизводные бензолсульфонамида - обладают антибактериальной (бактериостатической) активностью (табл. 10.10). Сульфаниламидные препараты используют при инфекциях, вызванных грамположительными и грамотрицательными бактериями, некоторыми простейшими - возбудителями малярии, токсоплазмоза. Сульфаниламидные препараты отличаются продолжительностью действия. Например, к препаратам короткого действия относятся стрептоцид и сульфатиазол (норсульфазол), тогда как сульфадиметоксин - препарат длительного действия. Строение и свойства Структурной единицей сульфаниламидов является амид n-аминобензолсульфоновой (сульфаниловой) кислоты:
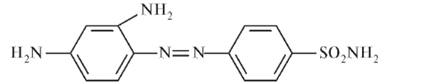
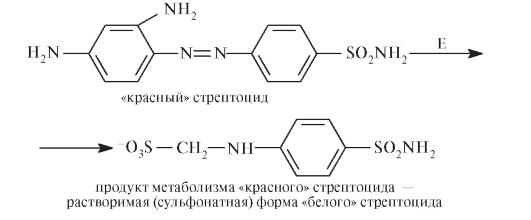
Белый стрептоцид был синтезирован в 1908 г. и использовался как полупродукт при получении красителей, но только через 27 лет, в 1935 г., была установлена терапевтическая активность сульфаниламидов. Немецкий бактериолог Г. Домагк (Gerhard Domagk, 1895-1964) в 1920-е годы в опытах на мышах и кроликах, зараженных смертельными дозами стафилококков и гемолитических стрептококков, обнаружил антибактериальное действие красителя пронтозила (4-сульфамидо-2,4-диаминоазобензола) - «красного» стрептоцида:
Проверке действия пронтозила на организм человека помог случай. У дочери ученого, повредившей палец, началась стрептококковая инфекция, и он в отчаянии дал ей дозу пронтозила. Клинические испытания препарата были завершены только в 1935 г. За эти годы были синтезированы и опробованы тысячи подобных препаратов на основе сульфаниламида.
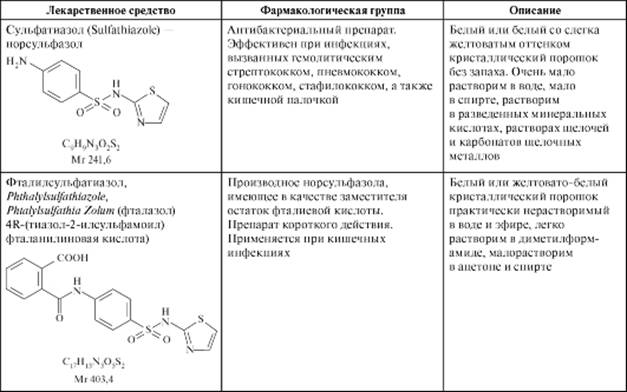
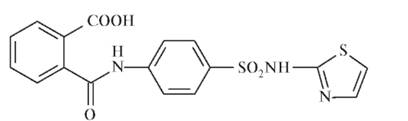
Таблица 10.10.Лекарственные средства - производные сульфаниламидов
Окончание табл. 10.10
За открытие антибактериального эффекта пронтозила и его производных Г. Домагк был награжден Нобелевской премией в 1939 г. Оказалось, что антимикробным действием обладает не сам пронтозил, а продукт его метаболизма:
Всего в мире было синтезировано несколько сотен соединений указанной структуры, около 30 из них используют в медицине. Как выяснилось, замена NH2-группы в бензольном кольце на -CH3, -OH, -Cl, -COOH приводит к полной потере активности. Однако активность сохраняется в случае заместителей, содержащих замещенную аминогруппу: -CONH-, RN-, NH-, (CH3)2N-. В молекуле бензолсульфонамида возможно одновременное замещение по амино- и сульфонамидной группе, например, в молекуле фталазола (фталилсульфатиазола):
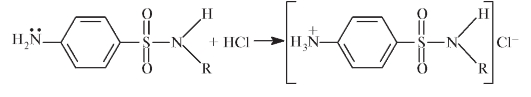
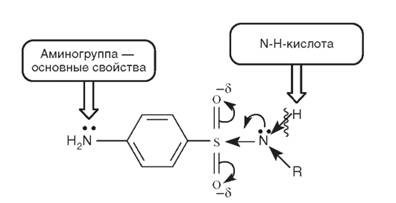
Химические свойства замещенных по амидной группе сульфаниламидов можно проследить по схеме (рис. 10.2). Таким образом, сульфонамиды проявляют амфотерные свойства. Ароматическая аминогруппа (основный центр) легко протонируется:
Рис. 10.2.Кислотный и основный центры в молекуле сульфонамидов
Основность ароматических аминов существенно ниже, чем аминов алифатического ряда, из-за _р,л-сопряжения и присутствия электроноакцепторных заместителей. Одновременно эти соединения - слабые NH-кислоты. Кислотные свойства усиливаются за счет _р,л-сопряжения в сульфонамидном фрагменте:
Кислотные свойства изменяются в зависимости от природы заместителя R. Например, при ацилировании происходит увеличение кислотности:
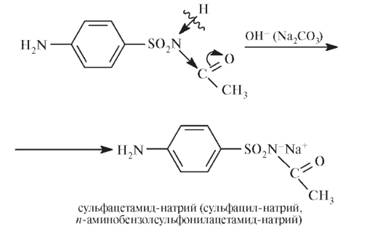
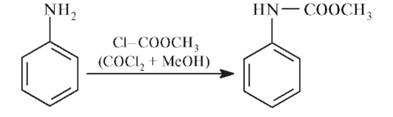
Получение Исходным продуктом синтеза сульфаниламидов является анилин. На первой стадии проводят защиту аминогруппы в анилине, используя в качестве реагентов хлорангидрид угольной кислоты в метаноле (метиловый эфир хлорметановой кислоты).
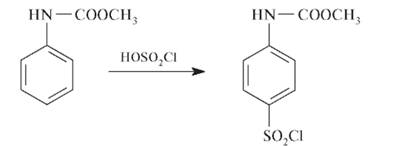
Образующийся карбамат при взаимодействии с хлорсульфоновой кислотой дает замещенный сульфанилхлорид:
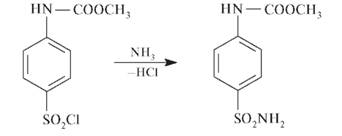
При обработке сульфанилхлорида аммиаком образуется сульфаниламид:
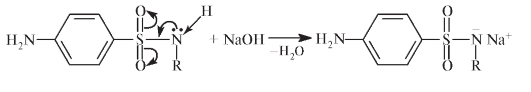
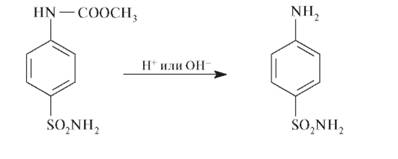
Регенерацию свободной аминогруппы проводят в кислой или щелочной среде:
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 506. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |