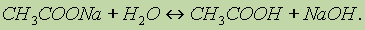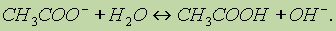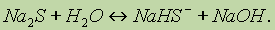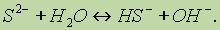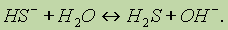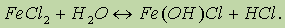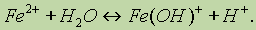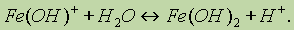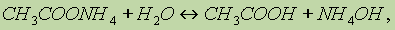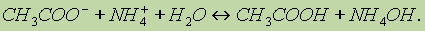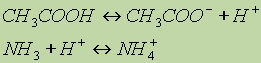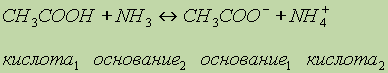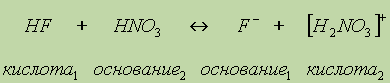Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Взаимодействие солей с водой, в результате которого образуются кислота (или кислая соль) и основание (или основная соль), называется гидролизом солей.Причиной гидролиза является электролитическая диссоциация соответствующих солей и воды. Вода незначительно диссоциирует на ионы Н+ и ОН , но в процессе гидролиза один или оба из этих ионов могут связываться ионами, образующимися при диссоциации соли, в малодиссоциированные, летучие или труднорастворимые вещества. Рассмотрим гидролиз солей следующих основных типов: 1. Соли сильного основания и сильной кислоты, при растворении в воде (например, NaCI, CaCl2, К2SO4) не гидролизуются, и раствор соли имеет нейтральную реакцию. 2. Соли сильного основания и слабой кислоты, напримерКСlO, Na2CO3, СН3СООNа, NaCN, Na2S, К2SiO3. Запишем уравнение гидролиза ацетата натрия:
В результате реакции образовался слабый электролит — уксусная кислота. В ионном виде этот процесс можно записать так:
Следовательно, раствор СН3СООNа будет проявлять щелочную реакцию. При растворении солей многоосновных кислот гидролиз протекает ступенчато, например:
или в ионной форме
Этот процессотражает гидролиз Na2S по первой ступени. Чтобы гидролиз прошел полностью, как правило, увеличивают температуру процесса:
Таким образом, при растворении в воде соли сильного основания и слабой кислоты раствор приобретает щелочную реакцию вследствие гидролиза. 3. Соли слабого основания и сильной кислоты, например Аl2(SO4)3, FeCl2, CuBr2, NH4Cl. Рассмотрим гидролиз хлорида железа(II):
В ионном виде этот процесс можно записать так:
По второй ступени гидролиз протекает следующим образом:
Из приведенных реакций ясно, что в результате гидролиза солей слабого основания и сильной кислоты раствор приобретает кислую реакцию.  4. Соли слабого основания и слабой кислоты, например Al2S3, Сr2S3, СНзСООNН4, (NH4)CO3. При растворении в воде таких солей образуются малодиссоциирующие кислота и основание:
или в ионном виде: Реакция среды в растворах подобных солей зависит от относительной силы кислоты и основания. Другими словами, водные растворы таких солей могут иметь нейтральную, кислую или щелочную реакцию в зависимости от констант диссоциации образующихся кислот и оснований. Так, при гидролизе СН3СООNН4 реакция раствора будет слабощелочной, поскольку константа диссоциации гидроксида аммония (К = 6,3 10 5) больше константы диссоциации уксусной кислоты (К = 1,75 10 5). Протонные кислоты.Электролитическая диссоциация явилась основой успешного развития теории растворов и изучения процессов, протекающих в них. В этом заключается ее большое значение в химии. Однако эта теория не объясняет процессов, протекающих в неводных растворах. Так, например, если хлорид аммония в водном растворе ведет себя как соль (диссоциирует на ионы NН4+ и Сl ), то в жидком аммиаке он проявляет свойства кислоты, — растворяет металлы с выделением водорода. Как основание ведет себя азотная кислота, растворенная в жидком фтороводороде или в безводной серной кислоте. Эти факты не согласуются с теорией электролитической диссоциации. Их объясняет протолитическая теория кислот и оснований, предложенная в 1923 г. независимо датским ученым Бренстедом и английским ученым Лоури. Согласно этой теории кислотами являются вещества, молекулы или ионы, отщепляющие при данной реакции протоны. Основаниями являются вещества, молекулы или ионы, присоединяющие протоны. Как те, так и другие получили общее название протолитов. Реакция отщепления протона изображается уравнением: кислота основание + Н+ Кислота и основание такого процесса называется сопряженными. Это кислотно-основная пара. Например, ион H3О+ — кислота, сопряженная основанию H2O, а хлорид-ион Cl — основание, сопряженное кислоте HCI. Свободные протоны в растворах самостоятельно не существуют. Они переходят от кислоты к какому-либо основанию. Поэтому в растворе всегда протекают два процесса: кислота1 основание1 + Н+ основание2 + Н+ кислота2 и равновесие между ними изображают уравнением кислота1 + основание2 основание1 + кислота2 Например, реакцию нейтрализации уксусной кислоты аммиаком можно представить так:
Здесь уксусная кислота является кислотой (отдает протоны Н+), аммиак — основанием (принимает протоны), ионы СН3СОО играют роль основания (в этом обратимом процессе они могут принять протоны и превратиться обратно в уксусную кислоту), а ионы аммония NH4+ играют роль кислоты (могут отдать протоны). Аналогично можно изобразить проявление основных свойств азотной кислоты, растворенной в жидком фтороводороде:
Таким образом, из кислоты и основания всегда получаются новые сопряженные кислота и основание. Протолитическая теория рассматривает реакцию нейтрализации как переход протона кислоты к основанию. Протолитическая теория расширила круг кислот и оснований по сравнению с представлениями теории электролитической диссоциации: ими могут быть и ионы. Одно и то же вещество а зависимости от того, с чем оно реагирует, может быть или кислотой, или основанием. Теория вскрыла относительность понятий о кислотах и основаниях и показала, что продукты их взаимодействия следует рассматривать как новые кислоты и основания. Протолитическая теория является современной и более общей теорией кислот и оснований. Кислоты Льюиса.Еще более общее определение кислот и оснований предложил Г. Льюис. Он предположил, что кислотно-основные взаимодействия совсем необязательно происходят с переносом протона. В определении кислот и оснований по Льюису основная роль отводится участию электронных пар в химическом взаимодействии. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 393. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |