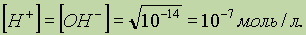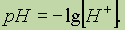Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Электропроводность растворов электролитовУдельная электропроводность растворов электролитов Электрический ток есть упорядоченное перемещение заряженных частиц. Растворы электролитов обладают ионной проводимостью (являются т.н. проводниками второго рода), т.е. электропроводность растворов электролитов обусловлена перемещением ионов в электрическом поле (в отличие от электронной проводимости проводников первого рода). Величина преимущественного передвижения иона в направлении одного из электродов при прохождении тока через раствор отнесённая к градиенту потенциала 1 В/см, есть абсолютная скорость движения иона. Абсолютные скорости движения ионов имеют величины порядка 0,0005 – 0,003 см2/(В·с). В качестве количественной меры способности раствора электролита проводить электрический ток используют обычно удельную электропроводность κ (каппа). Величина удельной электропроводности электролита зависит от ряда факторов: -природы электролита; - температуры; - концентрации раствора. Удельная электропроводность растворов электролитов (в отличие от электропроводности проводников первого рода) с увеличением температуры возрастает, что вызвано увеличением скорости движения ионов за счет понижения вязкости раствора и уменьшения сольватированности ионов.
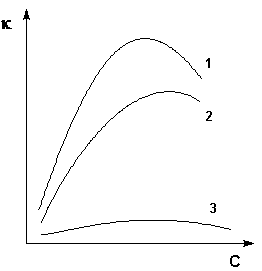
Рис. 3 Зависимость удельной электропроводности электролитов от концентрации
Как видно из рисунка, с увеличением концентрации удельная электропроводность растворов сначала возрастает, достигая некоторого максимального значения, затем начинает уменьшаться. Эта зависимость очень чётко выражена для сильных электролитов и значительно хуже для слабых. Наличие максимума на кривых объясняется тем, что в разбавленных растворах сильных электролитов скорость движения ионов мало зависит от концентрации, и κ сначала растет почти прямо пропорционально числу ионов; с ростом концентрации усиливается взаимодействие ионов, что уменьшает скорость их движения. Для слабых электролитов наличие максимума на кривой обусловлено тем, что с ростом концентрации уменьшается степень диссоциации, и при достижении определенной концентрации число ионов в растворе начинает увеличиваться медленнее, чем концентрация. Для учета влияния на электрическую проводимость растворов электролитов их концентрации и взаимодействия между ионами введено понятие молярной электропроводности раствора.  РН растворов Т.к. концентрации водорода и гидроксид-ионов очень маленькое число, то для удобства введено понятие рН - раствора. рН - раствора - значение десятичного логарифма молярной концентрации ионов водорода, взятого с обратным знаком, т.е. зная концентрацию ионов водорода (Н+), можно определить рН и наоборот: рН равен 7 - среда нейтральная, рН больше 7 - среда щелочная (Н+) больше 10-7 рН меньше 7 - среда кислая (Н+) меньше 10-7 Ионное произведение воды.Константа воды При диссоциации воды (см. уравнение выше) на каждый ион Н+ образуется один ион ОН , следовательно, в чистой воде концентрации этих ионов должны быть одинаковы: [H+] = [ОН ]. Используя значение ионного произведения воды, находим:
Такова концентрация ионов Н+ и ОН в чистой воде. Рассмотрим, как изменится концентрация при добавлении других веществ, например соляной кислоты. Соляная кислота — сильный электролит, диссоциирующий в воде на ионы H+ и Cl . Следовательно, концентрация ионов Н+ в растворе будет увеличиваться. Однако ионное произведение воды от концентрации не зависит, поэтому при увеличении [Н+] должна уменьшаться [ОН ]. Напротив, если к воде добавить щелочь, то концентрация [ОН ] увеличится, а[Н+] уменьшится. Таким образом, концентрации [Н+] и [ОН ] взаимосвязаны: чем больше одна величина, тем меньше другая, и наоборот. Кислотность растворов обычно выражают через концентрацию ионов Н+. В кислых растворах [Н+]>10-7 моль/л, в нейтральных [Н+] = 10-7 моль/л, в щелочных [Н+]< 10-7 моль/л. рН раствора.Чтобы не писать числа с показателем степени, кислотность раствора часто выражают через отрицательный логарифм концентрации ионов водорода, называя эту величину водородным показателем и обозначая ее рН:
В кислых растворах рН < 7, в нейтральных рН = 7, в щелочных рН > 7.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 605. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
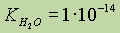 . Эту константу для воды называют ионным произведением воды. Ионное произведение воды зависит только от температуры; при повышении температуры оно увеличивается.
. Эту константу для воды называют ионным произведением воды. Ионное произведение воды зависит только от температуры; при повышении температуры оно увеличивается.