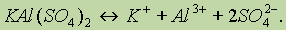Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Свойства растворов сильных электролитов - свойства содержащихся в них ионов.1. КИСЛОТЫ – содержат ион Н+. 1.1. способность взаимодействовать с основаниями с образованием солей; 1.2. способность взаимодействовать с некоторыми металлами с выделением водорода; 1.3. способность изменять цвет индикаторов – лакмус краснеет; 1.4. кислый вкус. 2. ОСНОВАНИЯ – содержат гидроксид-ион ОН-. 2.1. способность взаимодействовать с кислотами сообразованием солей; 2.2. способность иначе чем кислоты изменять цвет индикаторов- лакмуссинеет; 2.3. своеобразный «мыльный» вкус; 2.4. амфотерные гидроксилы (цинка, алюминия, хрома и некоторых других) образуют амфотерные электролиты;
3. СОЛИ - содержат положительные ионы, отличные от ионов Н+ и отрицательные ионы отличные от гидроксид-ионов ОН-. Таких ионов, которые были бы общими для всех солей, нет, поэтому соли не обладают общими свойствами.
Основные классы неорганических веществ: а) Оксиды. Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород. Почти все химические элементы образуют оксиды. До настоящего времени еще не получены оксиды трех элементов — благородных газов гелия, неона и аргона. Согласно международной номенклатуре названия оксидов образуют из латинского корня названия элемента с большей относительной электроотрицательностью с окончанием-ид и русского названия элемента с меньшей относительной электроотрицательностью в родительном падеже. Если же элемент образует несколько оксидов, то в их названиях указывается степень окисления элемента римской цифрой в скобках сразу после названия. Например, Н2О — оксид водорода (вода), FeО — оксид железа (II), Fe2O3 — оксид железа (III), Р2O3 — оксид фосфора (III), Р2О5 — оксид фосфора (V), P4O6 — гексаоксид тетра-фосфора, Р4O10 — декаоксид тетрафосфора, Сu2О — оксид меди (I) или оксид димеди.  Особую группу кислородных соединений элементов составляют пероксиды. Обычно их рассматривают как соли пероксида водорода Н2O2, проявляющего слабые кислотные свойства. У пероксидов атомы кислорода химически связаны не только с атомами других элементов, но и между собой (образуют пероксидную группу —О—О—. Например, пероксид натрия Na2О2 (пероксо- — название группы —О—О—). Надо уметь правильно определять степень окисления элементов в пероксидах. Так, в пероксиде бария ВаO2 степень окисления бария равна +2, а кислорода -1. По химическим свойствам оксиды делятся на три группы: основные, кислотные и амфотерные. Основные оксиды. Основными называются такие оксиды, которым соответствуют основания. Например, Nа2O, СаО, FеО, NiO являются основными оксидами, так как им соответствуют основания NаОН, Са(ОН)2, Fе(ОН)2, Ni(ОН)2. Некоторые основные оксиды при взаимодействии с водой образуют основания:
Другие основные оксиды непосредственно с водой не взаимодействуют, а соответствующие им основания получаются из солей:
Основные оксиды образуются только металлами. Кислотные оксиды. Кислотными оксидами называются такие оксиды, которым соответствуют кислоты. Например, СО2, P2O5, SO2, SO3 — кислотные оксиды, так как им соответствуют кислоты H2CO3, H3PO4, H2SO3, H2SO4. Большинство кислотных оксидов образуют кислоты при взаимодействии с водой:
Некоторые же кислотные оксиды с водой не взаимодействуют. Однако сами они могут быть получены из соответствующей кислоты:
Кислотные оксиды образуются неметаллами и некоторыми металлами, проявляющими высокие степени окисления (например, оксиду Mn2О7, отвечает марганцовая кислота НMnO4). Амфотерные оксиды. Амфотерными называются такие оксиды, которые в зависимости от условий проявляют основные или кислотные свойства, т.е. обладают двойственными свойствами. К ним относятся некоторые оксиды металлов: ZnO, Аl2O3, Cr2O3 и др. Амфотерные оксиды с водой непосредственно не соединяются, но они реагируют и с кислотами, и с основаниями:
При сплавлении А2O3 со щелочами или карбонатами щелочных металлов образуются метаалюминаты (безводные алюминаты):
Основные, кислотные и амфотерные оксиды являются солеобразующими, т.е. обладают способностью образовывать соли (при взаимодействии с кислотами или основаниями). Имеется небольшая группа оксидов, которые не проявляют ни основных, ни кислотных свойств и не образуют солей Такие оксиды называются безразличными или индифферентными. К ним, например, относятся оксид углерода (II) СО, оксид азота (I) N2O, оксид азота (II) NO и оксид кремния (II)SiO. Кислоты, соли и основания в свете теории диссоциации электролитов. Определения кислот, солей и оснований с точки зрения теории диссоциации были даны С. Аррениусом. б) Кислоты. Кислотой называется соединение, образующее при диссоциации в водном растворе из положительных ионов только ионы водорода Н+. В соответствии с этими определениями к кислотам относятся, например, НСl, H2SO4, HNO3, H2S. Примеры уравнений диссоциации кислот можно записать с учетом гидратации ионов:
Числом ионов водорода, образуемых каждой молекулой кислоты при диссоциации, определяется заряд кислотного остатка (аниона). Соляная и азотная кислоты образуют только однозарядные кислотные остатки (Сl- ,NО3-); молекула серной кислоты (Н2SO4 может образовать два кислотных остатка: однозарядный (НSO4-) и двухзарядный (SO42-); молекула фосфорной кислоты может дать три кислотных остатка: однозарядный, двухзарядный и трехзарядный (Н2РО4-, НРО42- и РО43-). Различают кислородные и бескислородные кислоты. Как показывает само название, первые содержат кислород (например Н2SO4, НNO3, Н3РО4), вторые его не содержат (например, НСl, НВr, НI, H2S). Названия кислородных кислот производятся от названия неметалла с прибавлением окончаний -ная, -вая, если степень окисления его соответствует номеру группы. По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая. Если элемент в одной и той же степени окисления образует несколько кислородсодержащих кислот, то к названию кислоты с меньшим содержанием кислородных атомов добавляется префикс “мета”, принаибольшем числе — префикс “орто”. Названия бескислородных кислот производятся от названия неметалла с окончанием -о и прибавлением слова водородная. в) Основания. Основанием называется соединение, образующее при диссоциации в водном растворе из отрицательных ионов только гидроксид-ионы ОН . В соответствии с этими определениями к основаниям относятся, например, NaOH, Са(ОН)2, NH4OH. Диссоциацию оснований с учетом гидратации ионов следует писать так:
Согласно международной номенклатуре названия оснований составляются из слова гидроксид и названия металла. Например, NаОН — гидроксид натрия, КОН — гидроксид калия, Са(ОН)2 — гидроксид кальция. Если элемент образует несколько оснований, то в названиях указывается степень его окисления римской цифрой в скобках: Fe(ОН)2 — гидроксид железа (II), Fе(ОН)3 — гидроксид железа (III). Помимо этих названий, для некоторых наиболее важных оснований применяются и другие, в основном традиционные русские названия. Например, гидроксид натрия NаОН называют едкий натр; гидроксид калия КОН — едкое кали; гидроксид кальция Са(ОН)2 — гашеная известь; гидроксид бария Ва(ОН)2 — едкий барит. Амфотерные гидроксиды. Амфотерными называются такие гидроксиды, которые при диссоциации образуют одновременно и катионы водорода Н+, и гидроксид-ионы ОН-. Такими являются Аl(ОН)3, Zn(ОН)2, Сr(ОН)3, Ве(ОН)2, Gе(ОН)2, Sn(ОН)4, Рb(ОН)2 и др. Амфотерные гидроксиды взаимодействуют как с растворами кислот, так и с растворами щелочей:
В настоящее время растворение амфотерных гидроксидов в щелочных растворах обычно рассматривается как процесс образования гидроксосолей (гидроксокомплексов). Экспериментально доказано существование гидроксокомплексов многих металлов: [Zn(OH)4]2-, [Al(OH)4(H2O)2]-, [Al(OH)6]3- и т.д. Наиболее прочны гидроксокомплексы алюминия, а из них —[Al(OH)4(H2O)2]-. Такой подход не меняет сделанных выводов: у амфотерного гидроксида, например у А1(ОН)3 и ему подобных, в кислой среде равновесие смещается в сторону образования солей алюминия, в щелочной — в сторону образования гидроксокомплексов. Очевидно, в водном растворе существует равновесие, которое более точно описывается уравнением:
г) Cоли. Солями называются соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов и отрицательно заряженные ионы кислотных остатков, а иногда, кроме них, ионы водорода и гидроксид-ионы:
В соответствии с данным определением соли делятся на средние (Na2SO4), кислые (NaHSO4) и основные (Mg(OH)Cl). После Аррениуса было показано, что определение кислот, солей и оснований в терминах теории электролитической диссоциации не охватывает всего многообразия кислотно-основных свойств веществ. Так, например, в рамки приведенных определений не укладываются соли NH4Cl и хлорид фениламмония C6H5NH3Cl, основание NH3 и др. Уравнения диссоциации солей, с учетом гидратации ионов, следует записывать так:
Любую соль можно представить как продукт взаимодействия основания и кислоты, т.е. реакции нейтрализации:
Уравнение диссоциации средней соли Na2SO4 можно записать так:
Если основания взято меньше, чем требуется для полной нейтрализации серной кислоты, то при упаривании будут выпадать кристаллы кислой соли:
Диссоциацию кислой соли можно выразить уравнением:
Анион кислой соли подвергается вторичной диссоциации как слабый электролит:
Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют. Основные соли можно представить как продукт неполного замещения гидроксогрупп основания на кислотные остатки:
Диссоциацию основной соли можно выразить уравнением
Катион основной соли в незначительной степени подвергается дальнейшей диссоциации:
Двойные соли состоят из ионов двух разных металлов и кислотного остатка. Например, КАl(SO4)2, (NН4)2Fe(SO4)2. Диссоциацию таких солей можно выразить уравнениями:
Двойные соли диссоциируют на ионы металлов и кислотного остатка. В состав комплексных солей входят сложные (комплексные) ионы (в формулах они заключаются в квадратные скобки), которые и отщепляются при диссоциации:
В свою очередь сложные (комплексные) ионы в очень малой степени подвергаются дальнейшей диссоциации:
Таким образом, комплексные соли при диссоциации сначала отщепляют комплексные ионы, которые затем подвергаются вторичной диссоциации как слабые электролиты. Наиболее распространены международные названия солей. Они состоят из двух слов: название аниона в именительном падеже и катиона в родительном. Число анионов и катионов, как правило, не указывается. Но если один и тот же металл проявляет различную степень окисления, то ее указывают в скобках римской цифрой. Например, КNO3 — нитрат калия, FeSO4 — сульфат железа (II), Fe2(SO4)3 — сульфат железа (III), NaС1 — хлорид натрия. Названия кислых солей образуются добавлением к аниону приставки гидро-, а если необходимо, то с соответствующими числительными: NаНSO4 — гидросульфат натрия; КН2PO4 — дигидрофосфат калия. Названия основных солей образуют, добавляя к наименованию аниона соответствующей средней соли приставки “гидроксо”: Аl(ОН)SO4 — гидроксосульфат алюминия, А1(ОН)2Cl — дигидроксохлорид алюминия. Гидролиз солей.Реакция чистой воды является нейтральной (рН = 7). Водные растворы кислот и оснований имеют соответственно кислую (рН < 7) и щелочную (рН > 7) реакцию. Практика, однако, показывает, что не только кислоты и основания, но и соли могут иметь щелочную или кислую реакцию — причиной этого является гидролиз солей. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 356. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |