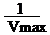Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Эталоны ответов на ситуационные задачиЗадача 1.График Лайнуивера-Берка – график двойных обратных величин (1/V против 1/S).
Отрезок на горизонтальной оси = Отрезок на вертикальной оси = Тип ингибирования неконкурентный, т.к. в присутствии ингибитора Кm (т.е. сродство фермента к субстрату ) не изменилось. Задача 2.В присутствии ингибитора прямая прошла через ту же точку на оси ординат, тогда как отрезок на оси абсцисс, с помощью которого можно рассчитать Km уменьшился. Исходное значение Km=-1/-1 =1 ммоль/л, в присутствии ингибитора- Km=-1/-0,5=2 ммоль/л. Увеличение значения Km отражает уменьшение сродства к ферменту, что наблюдается при конкурентном ингибировании. Задача 3.Сигмоидный характер кривой зависимости скорости ферментативной реакции от концентрации субстрата характерен для аллостерических ферментов, являющихся, как правило, олигомерными белками. S-образная форма кривой отражает кооперативное взаимодействие субъединиц при связывании субстарата. При воздействии солей ртути происходит диссоциация олигомера и высвобождается каталитически более активная субъединица, имеющая характеристики, подчиняющиеся кинетике Михаэлиса-Ментен. Подобным образом активируется и фермент протеинкиназа А, в данном случае диссоциация неактивного олигомера инициируется циклическим АМФ. Занятие № 7. Количественное определение активности ферментов. Основные принципы энзимодиагностики и энзимотерапии. Цель занятияосвоить методы определения активности ферментов и единицы выражения активности ферментов, охарактеризовать значение определения активности ферментов для диагностики заболеваний.

Содержание занятия. На данном занятии после проверки выполнения заданий по самоподготовке студентам предстоит ответить на тесты программированного контроля и вопросы преподавателя. Лабораторный практикум включает определение активности амилазы слюны, лактатдегидрогеназы и ее изоферментов в сыворотке крови. УИРС. Обсуждение реферативных сообщений, решение ситуационных задач, исследование активности амилазы мочи. |
||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 517. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||