Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Работа № 2. Очистка белков от низкомолекулярных примесей методом диализа.Принцип методаоснован на неспособности молекул белка (коллоидных частиц) проникать через полупроницаемую мембрану (пергамент, целлофан, колодий и др.), в то время как низкомолекулярные примеси легко проходят через поры этих мембран. Метод диализа широко используется для разделения и очистки белков и других биополимеров от примесей солей и низкомолекулярных органических соединений. Основанный на этом же принципе метод гемодиализа (вивидиффузия), применяется для лечения больных с почечной недостаточностью (аппарат «искусственная почка»). Ход работы. В подготовленный колодиевый или целлофановый мешочек поместить 1 мл сыворотки крови (раствора яичного белка) и 3-4 мл 6% раствора хлористого натрия, аккуратно поместить их в стакан с дистиллированной водой. Через 30-60 минут с небольшими порциями диализируемого раствора белка (содержимое мешочка) и диализата (наружная жидкость) провести пробы на хлориды и белок, чтоб удостовериться в том, что соль диффундировала, а белок остался в мешочке. Для обнаружения белка провести биуретовую реакцию. Принцип метода. Реакция основана на способности пептидной группы белков и полипептидов образовывать с ионами меди в щелочной среде комплексные соединения фиолетового цвета. Реакция позволяет обнаружить наличие пептидной связи в исследуемом веществе и, следовательно, является универсальной реакцией для обнаружения веществ белковой природы. Свое название реакция получила от производного мочевины биурета, который дает в данных условиях то же окрашивание, что и белок. Техника проведения работы. В пробирку добавить 5 капель раствора белка, 10 капель раствора едкого натра и 1 каплю раствора сульфата меди. Отметить появление красно-фиолетового окрашивания.  Для обнаружения хлоридов к 0,5-1 мл раствора добавить 1-2 капли 1% раствора азотной кислоты и 1-2 капли 1% раствора азотнокислого серебра и отметить выпадение творожистого осадка.
Работа № 3. Очистка от низкомолекулярных примесей методом гельфильтрации на сефадексе (молселекте). Основным свойством декстранового геля, как хроматографического материала, является способность разделять вещества согласно размерам молекул. Крупные молекулы при хроматографии не проникают в частицы геля и элюируются в свободном объеме, т.е. в свободном пространстве между частицами геля. Применяя сефадексы (молселекты) разных типов с разными размерами частиц и изменяя условия хроматографии; гель-фильтрацию на сефадексах (молселектах) можно использовать для разделения смесей в зависимости от молекулярной массы, для определения чистоты веществ, а также в целях обессоливания и концентрирования растворов высокомолекулярных соединений и др. Расчеты показывают, что на сефадексе Г-25 (молселекте Г-25) молекулы массой 5600 уже будут элюировать в свободном объеме, а соли и органические вещества с молекулярной массой в пределах 1000 проникают в частицы декстранового геля, обладая коэффициентом распределения 0,7-1,0. Это позволяет сравнительно легко отделить с помощью сефадекса Г-25 (молселекта Г-25) соли и низкомолекулярные органические примеси из растворов белков и других молекул.
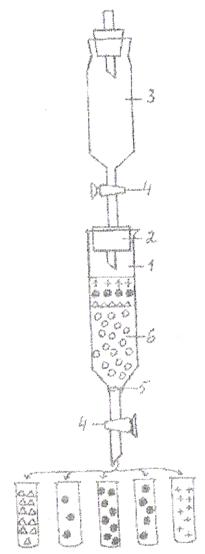
Рисунок 3. Схема устройства для гель-фильтрации. 1-колонка; 2-пробирка со стеклянной трубкой; 3-капельница, содержащая элюирующий раствор; 4-зажим; 5-кружок фильтровальной бумаги; 6-поверхность суспензии геля; 7-изотонический раствор NaCl; 8-смесь фракционируемых веществ. ⌂-вода; •-Hb; +-изотонический раствор NaCl; о-молселект.
Ход работы. Предварительно производят подготовку сефадекса (молселекта) и наполняют колонку. Для этого около 50 г сефадекса Г-25 (молселекта Г-25), достаточного для заполнения 7-8 колонок, необходимо суспендировать в стакане 0,1% растворе хлористого натрия (около 400 мл) и оставить для набухания на двое суток. Затем раствор соли из стакана слить, залить дистиллированной водой, суспензию сефадекса (молселекта) взболтать, дать осесть основной массе геля, а воду с неосевшими частицами слить. Отделение мелких частиц сефадекса повторить 4-5 раз. Колонку размеров 2x10 см закрепить в штативе в строго вертикальном положении, на дно колонки поместить диск из плексигласа с отверстием и сверху на него опустить кружок фильтровальной бумаги. Колонку на 2/3 объема заполнить водой и в остальную часть постепенно вливать суспензию сефадекса высотой 2-3 см, начать медленно профильтровывать воду, продолжая добавление сефадекса. После образования слоя геля 5-6 см наполнение колонки прекратить, колонку закрыть и над слоем сефадекса поместить кружок фильтровальной бумаги. При наполнении колонки следить, чтобы в колонке не оставалось пузырьков воздуха, и над гелем был слой жидкости. Для проведения работы открыть подготовленную колонку, дать профильтроваться воде над слоем геля и наслоить пипеткой 1-1,5 мл 2% раствора гемоглобина или другого окрашенного белка с равным объемом 3% раствора хлористого натрия. Как только раствор профильтруется (войдет в гель), ополоснуть стенки колонки небольшим количеством дистиллированной воды и начать элюирование дистиллированной водой со скоростью тока примерно 0,5 мл в минуту. Элюаты объемом 2,5-3 мл собирать в отдельные пробирки. Через 12-15 минут элюирование прекратить, в исходном растворе белка и в отдельных фракциях элюата проверить наличие белка по окраске содержимого пробирок и наличие хлоридов реакцией с азотнокислым серебром (см. выполнение предыдущей работы). Эталоны ответов к тестовым заданиям Вид 1. 1.1. -а; 1.2. -б; 1.3. –б (аминокислота, имеющая наибольший отрицательный заряд прочнее удерживается положительно заряженными частицами смолы); 1.4. -в; 1.5. –а. Вид 2. 2.1. 1,2 –б; 3,4 –а; 2.2. 1-в; 2-а; 3-б. Вид 3. 3.1.–4; 3.2. –4; 3.3 -4 (детергент устраняет влияние заряда белка и разделение полностью определяется размером белковых молекул). Вид 4. 4.1.- В (+, +, +); 4.2. – А (+, +, +). |
|||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 605. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |