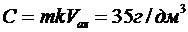Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Методика фотометричного визначення заліза
Залізо (ІІІ) утворює з сульфосаліциловою кислотою в залежності від рН середовища ряд забарвлених комплексів. При рН 1,8÷2,5 утворюється червоно-фіолетовий катіонний комплекс, що характеризується смугою поглинання з λmax= 510 нм і εmax= 1,8·103 . При збільшенні рН до 4÷8 розчин набуває червоно-буре забарвлення, яку приписують аніонному біс-комплексу. В лужному середовищі (9 < рН < 11,5) утворюється комплекс жовтого кольору зі смугою поглинання з λmax= 416 нм і εmax= 5,8·103. При рН > 12 даний комплекс руйнується і в осад випадає гідроксид заліза. Раніше вважали, що утворений в лужному середовищі комплекс являється трисульфосаліцилатом Fe (ІІІ), проте сучасні дослідження показали дещо іншу природу даного комплексу. Припускають, що його утворення пов’язане не з приєднанням третьої молекули реагенту, а з депротонуванням біс-комплексу. В результаті зміцнення зв’язку між атомом заліза і фенольним киснем відбувається зсув смуги поглинання біс-комплексу в короткохвильову область спектру. В практиці молекулярного абсорбційного аналізу використовують лише комплекси, утворені в кислому та лужному середовищах. Моносульфосаліцилатний комплекс використовують для визначення заліза (ІІІ) в присутності заліза (ІІ), магнію, марганцю, міді, алюмінію, рідкоземельних елементів. Флориди заважають визначенню Fe (ІІІ). В лужному середовищі в результаті легкого окиснення Fe (II) до Fe (ІІІ) за допомогою сульфосаліцилової кислоти можна визначити суму дво- та тривалентного заліза. Фторид-йони не заважають визначенню заліза у вигляді сульфосаліцилових комплексів у лужному середовищі.  Матеріали та обладнання Стандартний розчин заліза, 0,1 мг/см3; Сульфосаліцилова кислота, 10%-вий розчин; Сульфатна кислота, 1М розчин; Аміак, 10%-вий розчин; Мірні колби, піпетки, мірний циліндр; Аналітичні терези; Спектрофотометр КФК-2.
Порядок виконання аналізу
Визначення суми заліза (ІІ) та заліза (ІІІ) в лужному середовищі. Для побудови градуювального графіка в п’ять мірних колб місткістю 50 см3 перенести 20 см3 дистильованої води, стандартний розчин заліза з вмістом (мг): 0,1; 0,2; 0,5; 0,7; 0,10 відповідно, 10 см3 розчину сульфозаліцилової кислоти та 10 см3 розчину аміаку. Вміст колби довести до мітки і фотометрувати відносно дистильованої води. За отриманими даними побудувати градуювальний графік для визначення концентрації заліза (ІІІ) в досліджуваному розчині. Провести аналогічні операції з аліквотою розчину невідомої концентрації, виміряти його оптичну густину.
Проведення аналізу
Для того, щоб побудувати градуювальний графік, в сім мірних колб місткістю 50 см3 переносимо 20 см3 дистильованої води, стандартний розчин заліза з вмістом (мг): 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7 відповідно, в кожну із колб доливаємо 10 см3 розчину сульфосаліцилової кислоти та для створення лужних умов 10 см3 розчину аміаку. Вміст колби доводимо до мітки і фотометруємо відносно дистильованої води. Отримані результати заносимо до таблиці
Таблиця 3.1 – Результати вимірювань
Будуємо графік за вимірюваними величинами:
Максимальна довжина хвилі – Вихідний розчин розводимо в 10 разів. Відбираємо аліквоту
Таблиця 3.2 – Результати вимірювань
Знаходимо вміст заліза у досліджуваному розчині за градуювальним графіком, а потім підставляємо у формулу для розрахунку вмісту Fe (ІІІ) у досліджуваному розчині:
Оскільки 0,35 мг було в 1 см3, а колба була на 100 см3, то в колбі 0,35∙100=35 мг/100 см3 або 350 мг/дм3. А вихідний розчин розбавили в 10 разів, тому Свих=3,5 г/дм3 Висновки до розділу 3:
В даному розділі було проведено дослід. А саме фотометричне визначення заліза у розчині. Була визначена оптична густина розчинів. Освоєно методику проведення даного аналізу, а також набуто практичні навички застосування фотометрії для аналізу хімічних речовин. Вміст заліза складає 35 г/дм3. |
||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 396. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

 нм.
нм. см3 додаємо в колбу 10 см3 розчину сульфосаліцилової кислоти та для підтримання лужних умов 10 см3 розчину аміаку. Виставивши знайдену величину довжини хвилі, визначаємо оптичну густину. Дослід повторюємо сім разів. Результати заносимо до таблиці 3.2.
см3 додаємо в колбу 10 см3 розчину сульфосаліцилової кислоти та для підтримання лужних умов 10 см3 розчину аміаку. Виставивши знайдену величину довжини хвилі, визначаємо оптичну густину. Дослід повторюємо сім разів. Результати заносимо до таблиці 3.2.