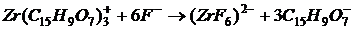Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Нефелометричний та турбідиметричний методи
У нефелометричному і турбідиметричному методах аналізу використані явища розсіювання або поглинання світла твердими або колоїдними частинками, що знаходяться в рідкій фазі в зваженому стані. Нефелометричним методом аналізу (нефелометрією) називають метод, заснований на вимірюванні інтенсивності світлового потоку, розсіяного твердими частинками, що знаходяться в розчині в зваженому стані. Турбідиметричним методом аналізу (турбідиметрією) називають метод, заснований на вимірюванні інтенсивності потоку, що пройшов через розчин, що містить зважені частинки. Інтенсивність зменшується унаслідок поглинання і розсіювання світлового потоку. Розсіювання і поглинання світла розчинами, що містять зважені частинки. Світло, проходячи через розчин, відбивається від достатньо великих частинок, що знаходяться в розчині. Тому приведене рівняння (1.16) приймає вигляд:
Значення обох членів рівняння залежать від концентрації зважених частинок в розчині. Інтенсивність розсіяного світла Інтенсивність потоку, що розсіюється невеликими частинками, підкоряється рівнянню Релея:
де N — загальне число частинок; V – об'єм частинки;
При нефелометричних дослідженнях величини

де К – коефіцієнт пропорційності. З рівняння (1.18) виходить, що інтенсивність розсіяного світлового потоку пропорційна числу дисперсних частинок, тобто концентрації визначуваної речовини. На інтенсивність розсіяного світлового потоку впливають не тільки кількість, але і розміри частинок – обставина, значно ускладнююче практичне виконання нефелометрического аналізу. Нарешті, множник При турбідиметричних вимірюваннях інтенсивність світлового потоку
де
С – концентрація поглинаючих частинок в розчині;
При постійних значеннях
Таким чином, основне рівняння турбідиметрії має вигляд, аналогічний рівнянню Бугера-Ламберта- Бера:
де Умови роботи. При нефелометричному і турбідиметричному аналізі необхідно дотримуватися ряду умов, що визначають успішність роботи. 1. Внаслідок того, що при виконання цих методів зазвичай досліджують сильнорозведені розчини, отриманий осад повинен мати малу розчинність. 2. Як видно з приведених рівнянь, значення розсіяного і поглинутого світла залежать від розмірів частинок, що знаходяться в розчині. Отже, отримання правильних результатів при аналізі суспензій залежить від методики отримання суспензій і від відтворюваності їх оптичних властивостей. На розміри частинок і оптичні властивості суспензії впливають наступні чинники: концентрація іонів, які утворюють осад; відношення між концентраціями змішуваних розчинів; порядок змішування розчинів; швидкість змішування; час, потрібний для отримання максимальної каламутності; стабільність дисперсії; присутність сторонніх електролітів; присутність неелектролітів; температура; наявність захисних колоїдів. Таким чином, вивчення всіх цих чинників і стандартизація умов підготовки речовини до нефелометричного визначення необхідні для правильної роботи. 3. Суспензії повинні бути стійкими в часі, тобто не осідати протягом достатнього тривалого часу. Для збільшення стійкості суспензій часто застосовують захисні колоїди. Всі ці обмеження приводять до того, що нефелометричні і турбідиметричні методи виявляються менш точними, чим описані вище фотометричні. У практиці аналітичної хімії вони використовуються тільки в тих випадках, коли визначувані іони або речовини не можна визначити фотометричними методами, наприклад сульфати і хлориди, які не дають стійких забарвлених сполук. В деяких випадках турбідиметричні визначення проводяться методом стандартних серій. Проте необхідність створення постійних умов визначення роблять цей метод дуже неточним, напівкількісним. Найбільш точні результати і в турбідиметрії, і в нефелометрії дають фотометричні методи вимірювання інтенсивності світла в різних варіантах [1]. Досить широко застосовується метод турбідиметричного титрування. При цьому можуть бути використані тільки такі реакції, які протікають швидко, наприклад реакції утворення хлориду срібла або сульфату барію, і не можуть бути використані реакції, проведення яких вимагає складних операцій. Рефрактометричнй метод
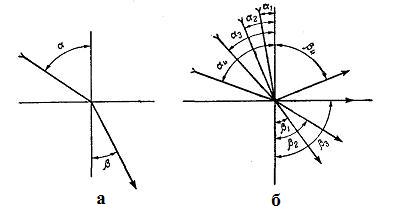
Рефрактометричні методи аналізу засновані на визначенні показника (коефіцієнта) заломлення досліджуваної речовини. Якщо промінь світла переходить з одного середовища в інше, то він частково відбивається від поверхні розділу, а частково переходить в друге середовище, змінюючи при цьому свій первинний напрям, тобто заломлюючись.
Рисунок 1.8 – Заломлення світла (а) і повне внутрішнє віддзеркалення (б)
Показником (коефіцієнтом) заломлення (
Якщо промінь світла переходить з вакууму або з повітря в інше середовище, то кут падіння завжди більший від кута заломлення. Якщо промінь світла переходить з середовища більш заломлюючого, в середовище менш заломлююче, то кут падіння виявляється менший ніж кут заломлення і приведена вище формула приймає вигляд:
При збільшенні кута падіння змінюється співвідношення між часткою світлової енергії, перехідної в інше середовище, і частиною світлової енергії, відбитої від поверхні розділу. Наприклад, під час переходу світлового променя із скла в повітря, залежно від кута падіння, кут заломлення і частка відбитого світла змінюються наступним чином (таблиця 1.1):
Таблиця 1.1 – Співвідношення кутів падіння та заломлення
При куті падіння 40° і вище промінь світла повністю відбивається від поверхні розділу. Цей кут називається кутом повного внутрішнього віддзеркалення (рисунок 4.1, б). З формули (4.2), якщо
де Отже, знаючи кут повного внутрішнього віддзеркалення, можна визначити значення показника заломлення. Цей спосіб визначення показника заломлення речовини використовується в багатьох конструкціях рефрактометрів. Проведення рефрактометричних досліджень у вакуумі зустрічає великі затруднення, і тому велика частина досліджень проводиться в повітрі. Показник заломлення повітря щодо вакууму невеликий 1,00027. Тому при вимірюваннях показника заломлення з точністю до третього знаку після коми поправкою на показник заломлення повітря можна нехтувати, при дослідженнях з точністю до 4 знаку слід вводити поправку, визначаючи дійсний коефіцієнт заломлення. При точніших вимірюваннях необхідно враховувати вплив на показник заломлення повітря тиску і температури. Для особливо точних вимірювань показника заломлення використовується інший принцип визначення – інтерферометричний. У цьому способі два пучки світла пропускають через однаково заломлюючі середовища, спостерігаючи при цьому інтерференційну картину. Іншу пару пучків світла пропускають через різні заломлюючі середовища, унаслідок різної швидкості світла в цих середовищах спостережувана картина інтерференції буде вже інша, яка зрушилась відносно раніше спостережуваної. Зрушення інтерференційних смуг пропорційне різниці показників заломлення середовищ. Інтерферометричним методом можна дуже точно визначити не абсолютне значення показника заломлення, а тільки різницю між показниками заломлення двох досліджуваних середовищ. Цей метод застосовують в тих випадках, коли показники заломлення трохи змінюються із зміною концентрації речовини, або коли показники заломлення досліджуваних речовин відрізняються один від одного не більше ніж на 0,01. Показник заломлення, згідно до законів оптики, залежить від швидкості розповсюдження світла у вакуумі і даному середовищі:
де
Електромагнітна теорія світла Максвела пов'язує показник заломлення з діелектричною проникністю
Діелектрична проникність залежить від поляризації молекули, її дипольних моментів. Таким чином і коефіцієнт заломлення відображає особливості будови молекули досліджуваної речовини.
Рисунок 1.9 – Залежність показника заломлення
Показник заломлення речовини залежить також від ряду інших чинників. Передусім він залежить від довжини хвилі падаючого світла: наприклад, для кварцу залежність Проте для багатьох кристалічних речовин спостерігається аномальний хід зміни показників заломлення зі зміною довжин хвиль. На рисунку 1.9, б приведені крива зміни показника заломлення того ж кварцу, але в далекій інфрачервоній області і крива пропускання. Як видно на рисунку, аномальна зміна показника заломлення спостерігається в області максимумів по кривій пропускання. Для показників заломлення завжди необхідно вказувати, якій довжині хвилі вони відповідають. Як вже вказувалось, показник заломлення пов'язаний з діелектричною проникністю речовини, однак слід враховувати, що показник заломлення зазвичай вимірюють для довжин хвиль в порядку 102 нм, діелектричну проникність – при метрових довжинах хвиль. Тому в рефрактометрії часто використовують показник заломлення Важливою величиною, що характеризує властивості речовини, є дисперсія – залежність показника заломлення від довжин хвилі світла. Мірою дисперсії служить різниця між значеннями показників заломлення, виміряних при різних довжинах хвиль. У практиці використовують різні види дисперсії. Показник заломлення залежить і від температури, тому при рефрактометричних вимірюваннях постійність температури грає дуже важливу роль. Показник заломлення газів залежить і від тиску. Загальна залежність показника заломлення газу від температури і тиску може бути виражена формулою:
де
Р — тиск, мм рт. ст.;
Були зроблені численні спроби знайти величини, пов'язані з показником заломлення, які не залежали б від зовнішніх чинників і відображали б внутрішню структуру речовини. Молекулярна рефракція широко використовується для фізико-хімічних розрахунків, визначення структури речовини, зв'язків у молекулах, ідентифікації органічних речовин. У аналізі, проте, частіше використовують не молекулярні рефракції, а безпосередньо показники заломлення. Для визначення вмісту цукру в розчині за показником заломлення користуються кривою залежності показника заломлення від змісту цукру (рисунок 1.10). Між цими величинами існує майже прямолінійна залежність. Проте така залежність дотримується не завжди; для розчину метилового спирту крива має інший вигляд (рисунок 1.10). Скористатися цими кривими для визначення вмісту метилового спирту в розчині неможливо, оскільки зміна показника заломлення невелика.
Рисунок 1.10 – Калібрувальні криві для рефрактометричних визначень СН3ОН і С12Н22011.
Для потрійних систем один показник заломлення не може однозначно визначити склад системи. В цьому випадку для визначення складу необхідні додаткові параметри, які використовують фізико-хімічні величини: густину, температуру кипіння, поверхневий натяг або деякі хімічні показники: йодне число, число омилення і так далі. Поляриметричний метод
Згідно електромагнітної теорії світла світлові хвилі є поперечними хвилями, тобто коливання їх відбуваються в площині, перпендикулярній до напряму променя. У природного променя коливання відбуваються у всіх площинах, перпендикулярних до його напряму (рисунок 1.11, а). При проходженні світла через різні кристали виявляється, що решітки деяких з них пропускають промені тільки певного направленого коливання. Після виходу з кристала коливання променя відбуваються вже тільки в одній площині. Промінь, коливання якого відбуваються тільки в якій-небудь одній площині, називається поляризованим променем. Площина, в якій відбуваються коливання променя називається площиною коливання поляризованого променя, а площина, перпендикулярна до неї, – площиною поляризації (рисунок 1.11, б).
Рисунок 1.11 – Природний (а) і поляризований (б) промені
Всі речовини і розчини можуть бути розділені на дві категорії залежно від їх відношення до поляризованого світла. Речовини, здатні змінювати (обертати) площину поляризації світла, є оптично активними речовинами; речовини, які не здатні змінювати площину поляризації світла, є оптично неактивними. Поляриметричний метод аналізу заснований на вимірюванні кута обертання площини поляризації променя світла, що пройшло через оптично активне середовище. При проходженні поляризованого світла через анізотропну – оптично активну – середовище може виникнути два ефекти: 1) зміна напрямів коливань – обертання площини поляризації; 2) розкладання плоскополяризованого променя на два компоненти, що володіють обертанням в різні боки. Розглянемо спочатку перший ефект – обертання площини поляризації. Оптична активність речовин обумовлюється двома чинниками: 1. особливостями кристалічної решітки речовини; 2. особливостями будови молекули речовини. Залежно від цих чинників оптично активні речовини розділяють на два типи. До першого типу відносяться тверді речовини – кристали, наприклад кварц S02, хлорат натрію NaClО3 та інші. Оптична активність деяких кристалічних осадів використовується в кристалохімії для визначення окремих іонів, наприклад оптична активність кристалічних осадів ТеАuCl4 і РbCl2 використовується для ідентифікації речовин. При плавленні або розчиненні, тобто при руйнуванні кристалічної решітки, такі кристали втрачають оптичну активність. Особливо широко використовується обертання площини поляризації кристалами в мікроскопічній техніці. Кристали відрізняються один від одного по напряму обертання (право- або лівообертальні), по ступеню обертання і по ряду інших ефектів. Ці оптичні показники є важливими характеристиками кристалів. Речовини другого типу проявляють активність тільки в розчиненому або газоподібному стані. Оптична активність їх обумовлена особливостями будови молекул. До цієї категорії речовин відносяться головним чином органічні речовини: глюкоза, винна кислота, морфін і ін. Оптично активні молекули не мають центру і площини симетрії. Визначення речовин другого типу складає одне з основних завдань поляриметричного аналізу. Аналіз розчинів оптично активних речовин. Очевидно, що поляриметричним методом можуть бути досліджені тільки оптично активні речовини, яких налічується декілька тисяч. Якщо через шар такої речовини проходить поляризований промінь, то площина поляризації його змінюється, тобто площина поляризації променя, що вийшов, виявляється поверненою на деякий кут, званий кутом обертання площини поляризації. Основною частиною будь-якого приладу для поляриметричного аналізу є поляризатор і аналізатор. Коли вони встановлені так, що їх площини поляризації взаємно паралельні, то промені світла проходять через них (рисунок 1.12, а). Якщо ж аналізатор повернути на 90° (рисунок 1.12, б) так, щоб площини поляризації виявилися взаємно перпендикулярними, то промені світла не можуть пройти через аналізатор, оскільки промені, що пройшли через поляризатор, мають площину коливань, перпендикулярну до площини пропускання променів аналізатором. В цьому випадку світла за аналізатором не виявляється. Таке положення називається постановкою аналізатора і поляризатора «на темноту». Якщо ж між аналізатором і поляризатором, поставленими «на темноту», помістити розчин оптично активної речовини (рисунок 1.12, в), то за аналізатором з'явиться світло.
Рисунок 1.12 – Схема розташування поляризатора і аналізатора при поляриметричному дослідженні
Поява світла пов'язана з тим, що промінь, який вийшов з розчину коливається вже не в площині, перпендикулярній до площини аналізатора, а в площині MN і може бути розкладений за правилом паралелограма на два променя OR і ОR (рисунок 1.12, г). Промінь OR коливається в площині пропускання променів аналізатора і, отже, може пройти через нього. Для того, щоб повторно поставити поляризатор і аналізатор «на темноту», необхідно аналізатор повернути так, щоб площина його стала перпендикулярною до площини MN, тобто на кут Таким чином визначається кут обертання площини поляризації. Цей кут залежить від товщини шару, концентрації розчину і індивідуальних властивостей оптично активної речовини. Всі ці величини зв'язані між собою рівняннями:
і
де
С – концентрація, г/100 мл; С′ – концентрація, г/мл; М – молярна маса; Ф – молярне обертання площини поляризації. Величини Обертання площини поляризації може відбуватися за годинниковою стрілкою і навпаки. У першому випадку обертання називають правим і величину Питоме обертання площини поляризації Із збільшенням температури питоме обертання збільшується. Залежність від температури зазвичай виражається степеневим рядом. Тому всі дослідження обертання площини поляризації повинні відноситися до певних значень довжини хвилі і температури. Звичайне питоме обертання площини поляризації відносять до 20 °С і жовтої лінії Питоме обертання площини поляризації рідких і твердих речовин є постійною величиною. Для розчинів, оптична активність яких обумовлена молекулярною будовою розчиненої речовини, питоме обертання площини поляризації залежить також від концентрації розчину. Як і залежність від температури, залежність питомого обертання площини поляризації від концентрації виражається зазвичай у вигляді статечного ряду. Часто формули питомого обертання виражають залежність обертання від концентрації речовини і від температури. Питоме обертання площини поляризації залежить також від розчинника, в якому розчинена досліджувана речовина. В деяких випадках спостерігається зміна питомого обертання площини поляризації в часі. Це явище називається мутаротацією і пов'язане з переходом однієї оптичної форми розчиненої речовини в іншу. У цукровій промисловості поляриметричний метод застосовує для визначення вмісту цукристих речовин. У масло-жировій промисловості він використовується спільно з рефрактометричним методом для ідентифікації масел. Деякі масла, що володіють однаковими показниками заломлення, мають значення питомого обертання площини поляризації, що різко відрізняються. У фармацевтичному виробництві поляриметрія використовується для ідентифікації деяких лікарських засобів. Так, камфора, виділена з камфорного базиліка, дає в спирті правообертальний розчин з питомим обертанням площини поляризації +8-6°, деякі сорти камфора, виділена з полину, дає лівообертальний розчин з питомим обертанням площини поляризації –8-6°, синтетична камфора не обертає площину поляризації. Люмінесцентний метод
У певних умовах поглинена атомами речовини енергія може виділятися у вигляді променистої енергії. Так, розжарене тіло випускає промені певних довжин хвиль. Деякі речовини володіють здатністю світитися «холодним світлом», яке називається люмінесцентним. Люмінесцентне світіння може бути викликане дією різних видів енергії. Світіння речовини може відбуватися під впливом бомбардування його потоком електронів – катодними променями. Таке світіння називається катодолюмінісценцією; воно використовується в лампах денного світла. Світіння, зване триболюмінісценція, виникає при механічному руйнуванні кристалів речовини. Під впливом енергії хімічних реакцій може відбуватися світіння, зване хемілюмінесценція. Нарешті, світіння може бути викликане поглинанням променистої енергії – фотолюмінісценція. По характеру люмінесцентного світіння розрізняють фосфоресценцію – світіння, що продовжується більш менш тривалий час після видалення джерела збудження світіння, і флуоресценцію – світіння, що припиняється відразу ж після видалення джерела збудження. Всі ці види світіння, схожі за своєю природою, об'єднуються загальним поняттям люмінесценції. Явище люмінесценції відоме дуже давно, проте детальне вивчення його починається тільки з кінця минулого сторіччя. Теорія люмінесцентного вивчення була дана на основі квантової теорії світла в 30-х роках XX століття. Практичне використання цього методу почалося ще пізніше, приблизно в 50-х роках. Зі всіх типів люмінесценції для аналітичних цілей використовується головним чином явище флуоресценції, що викликається променистою енергією. Залежно від характеру процесів, що відбуваються у флуоресціюючій речовині, розрізняють два види світіння: 1) світіння дискретними центрами, що виникає тоді, коли поглинають і випромінюють променисту енергію одні і ті ж молекули (так флуоресціюють рідини і пари); 2) рекомбінаційне світіння, що виникає у тому випадку, коли в перетворенні енергії бере участь вся флуоресціююча речовина (таке свічення виникає у кристалів). У фізико-хімічних методах аналізу використовують головним чином дискретне світіння розчинів. Природа люмінесцентного випромінювання може бути розглянута на простій енергетичній моделі молекули. У молекулі разом з основними енергетичними рівнями В процесі збудження електрон переходить на вищі рівні (І). Ці переходи супроводжуються поглинанням енергії, причому
Таким чином, перехід г вимагає поглинання променистої енергії коротших хвиль, ніж для переходу а або б.
Рисунок 1.13 – Рівні енергії і електронні переходи
Електрон, що знаходиться не на нульовому підрівні, може переходити на нульовий підрівень відповідного рівня (перехід д, рисунок 1.13). Ці переходи відповідають процесу коливальної дезактивації молекул і відбуваються під час зіткнень з молекулами інших речовин або розчинника і не супроводжуються випромінюванням променистої енергії. До моменту початку люмінесцентного випромінювання майже всі збуджені електрони знаходяться на вищих енергетичних підрівнях. Перехід електронів на нульові підрівні може відбуватися різними шляхами. Електрон з вищого підрівня може безпосередньо повернутися на нульовий підрівень (перехід е і ж, рисунок 1.13). В цьому випадку енергія випромінювання рівна енергії збудження:
Звідси
Якщо електрон з вищого підрівня спочатку переходить на проміжний підрівень, що не супроводжується виділенням енергії, а потім переходить на підрівень
і
Спектр випромінювання при цьому зрушується в бік більш довших хвиль. Таке положення спостерігається в більшості випадків "при випромінюванні спектрів поглинання і люмінесцентного випромінювання. Воно формулюється правилом Стокса – люмінесцентне випромінювання знаходиться в більш довгохвильовій частині спектру, чим поглинене світло. Спектральні характеристики променів, збуджених люмінесценцію, і самій люмінесценції приведені на рисунок 1.14. В деяких випадках процес переходу електрона може відбуватися ступінчато, з рівня 2 на рівень 1 шляхом безвипромінювального переходу, а з рівня 1 на 0 у супроводі люмінесцентного випромінювання (перехід і, рисунок 1.13). В цьому випадку, як і раніше:
і
Іноді в результаті комбінування променевої енергії з тепловою переходи електронів можуть відбуватися ступінчато: з рівня
Рисунок 1.14 – Спектральні характеристики променів, збуджених люмінесценцію (а) і люмінесцентне випромінюваня (б)
Трохи інший механізм рекомбінаційного випромінювання кристалів. Електрони в кристалах можуть знаходитися в зоні валентності і в зоні провідності. Знаходження електрона в зоні провідності пов'язане з вільним його пересуванням в кристалі і обумовлює електропровідність кристала. Між цими зонами розташовується заборонена зона, в якій електрон знаходиться в нестабільному стані (рисунок 1.15). Ці зони можуть знаходитися на достатньо великій відстані один від одного, можуть перекриватися, як це має місце у металів.
Рисунок 1.15 – Рівні енергії та електронні переходи в кристалах
Електрон, що знаходиться всередині валентної зони, отримуючи квант променевої енергії, здатний переходити в зону провідності (перехід 1, рисунок 1.15). У валентній зоні при цьому утворюється «дірка», заряджена позитивно, яка може пересуватися в кристалі подібно до електрона. Збуджений електрон в зоні провідності за рахунок безвипромінювального переходу енергії переходить на стелю забороненої зони, такий же процес відбувається з «діркою», яка переходить на дно забороненої зони (переходи 2 і 3, рисунок 1.15). Тепер може відбутися процес заповнення електроном «дірки» (перехід 4, рисунок 1.15). Такий процес супроводжується випромінюванням кванта променевої енергії і називається процесом рекомбінації. Випромінювання це називається рекомбінаційним. В деяких випадках електрон і «дірка» можуть переходити в заборонену зону на рівні електронної і діркової пасток (переходи 5 і 6, рисунок 1.15). Між електроном і «діркою» на цих рівнях також може відбутися процес рекомбінації (перехід 7, рисунок 1.15). Процеси випромінювання 4 і 7 відбуваються в чистих кристалах і супроводжуються випромінюваннями з малими довжинами хвиль. Присутність в кристалах деяких домішок (активаторів) створює в забороненій зоні нові енергетичні рівні: нормальний і збуджений. На ці рівні можуть переходити як електрон, так і «дірка» (переходи 8 і 9, рисунок 1.15), в результаті може відбуватися рекомбінація електрона і «дірки» з випромінюванням енергії. Це випромінювання часто лежить в області видимого світла. Можуть відбуватися і інші процеси рекомбінації, наприклад електрона, що знаходиться на стелі забороненої зони, з «діркою», що знаходиться на нормальному рівні активатора (перехід 11, рисунок 1.15). З численних типів люмінесценції найбільше значення має флуоресценція, яка характеризується 4 основними властивостями: · спектром поглинання і флуоресценції; · виходом флуоресценції; · тривалістю флуоресценції; · поляризацією флуоресцентного випромінювання. На рисунок 1.16 приведені спектральні характеристики деяких органічних речовин. Такі спектральні характеристики, що дозволяють відрізняти одну флуоресціюючу речовину від іншого, використовуються для якісного флуоресцентного аналізу. Максимуму спектру відповідає колір флуоресціюючого випромінювання.
1 – стильбен; 2 – нафтол; 3 – дифенілоктатетраєн.
Рисунок 1.16 – Спектри флуоресценції деяких речовин
Якісне визначення природи флуоресціюючої речовини в простому випадку може бути проведене за кольором флуоресціюючого випромінювання. Наприклад, деякі алкалоїди флуоресціюють характерним для них кольором: кокаїн – світло-синім, кодеїн – слабо-жовтим, нікотин – темно-фіолетовим. Таким чином, по забарвленню флуоресценції можна визначити присутність того або іншого алкалоїду в медичному препараті. По характеру флуоресценції можна розрізняти різні типи бітумів. Хлороформна витяжка володіє флуоресценцією; у легких бітумів – голубуватою або зеленуватою, легко зникаючою; у важких бітумів – яскраво-білою, такою, що поволі буріє до слабкою бурою або жовтою; у асфальтенів – білою, такою, що швидко буріє до слабкої темно-бурої, потім зникаючої. Якісний флуоресцентний аналіз застосовують для визначення марок скла, сортів змащувальних масел, для дослідження мінералів і тому подібне Для кількісного спектрального аналізу використовують значення виходу флуоресценції В або пов'язану з ним інтенсивність флуоресцентного випромінювання – Розрізняють вихід флуоресценції енергетичний Bен, рівний відношенню випромінюваної енергії Ефл до поглиненої енергії Епог, і квантовий Вкв, рівний відношенню числа квантів флуоресценції Nфл до квантів поглиненої енергії Nпог. Між цими величинами існує співвідношення:
де Інтенсивність флуоресценції
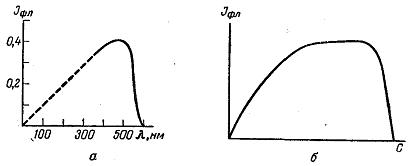
де К — коефіцієнт пропорційності; і — інтенсивність світлових потоків. Якщо величини і0, Вкв є постійні, що можна досягти проведенням дослідів в стандартних умовах, то інтенсивність флуоресценції буде пропорційна концентрації флуоресціюючої речовини. Інтенсивність флуоресценції зазвичай вимірюють в умовних одиницях. Прямолінійна залежність між інтенсивністю флуоресценції і концентрацією зберігається тільки при малих значеннях концентрації. Інтенсивність флуоресцентного випромінювання визначається методами, вживаними в колориметричному і фотоколориметричному аналізах. Вихід флуоресценції і інтенсивність флуоресцентного випромінювання залежать від ряду чинників. При збудженні флуоресценції монохроматичним світлом вихід залежить від довжини хвилі збудженого світла. Ця залежність підкоряється наступному закону (С. І. Вавілов): при люмінесценції може зберегтися постійний квантовий вихід, якщо збудлива хвиля перетвориться в середньому в довшу. Навпаки, вихід люмінесценції різко зменшується при зворотному перетворенні довгих хвиль в коротші. Оскільки інтенсивність флуоресценції пропорційна не тільки квантовому виходу, але і молярному коефіцієнту поглинання, який також залежить від довжини хвилі, залежність її від довжини хвилі виходить складнішою. При збільшенні довжини хвилі збудженого світла інтенсивність флуоресценції зростає до відомої межі, потім в деякому інтервалі хвиль залишається постійною, після чого при подальшому збільшенні довжини хвилі різко падає. Крива залежності інтенсивності флуоресценції від довжини збудливого світла приведена на рисунок 1.17, а. Вид цієї кривої залежить від природи флуоресціюючої речовини. Зокрема, припинення флуоресценції (спадаюча гілка кривої) у різних речовин розташовується в різному інтервалі хвиль.
Рисунок 1.17 – Залежність інтенсивності флуоресценції: а – від довжини хвилі; б – від концентрації флуоресціюючої речовини
Для кількісного аналізу особливий інтерес представляє залежність інтенсивності флуоресценції від концентрації флуоресціюючої речовини. Характерна крива залежності інтенсивності флуоресценції від концентрації представлена на рисунок 1.17, б. В області малих концентрацій між інтенсивністю флуоресценції і концентрацією існує пряма пропорційність. Саме ця область і використовується для кількісного аналізу. Для більшості речовин ця область охоплює концентрації порядку 10-7 – 10-4 моль/л. Таким чином, флуоресцентний метод застосовний для визначення незначних кількостей речовин в розчинах. З підвищенням концентрації інтенсивність флуоресценції стає майже постійною, а потім різко падає. Це зменшення інтенсивності флуоресценції із збільшенням концентрації називається концентраційним гасінням флуоресценції. При концентраційному гасінні змінюється не тільки інтенсивність, але і спектр флуоресценції. Явище концентраційного гасіння флуоресценції пояснюється декількома діями. При збільшенні концентрації відбувається зближення флуоресціюючих молекул. Це приводить до зміни їх енергетичних рівнів і збільшення кількості безвипромінювальних переходів. При зближенні молекул, навіть без зіткнення, виникає можливість резонансної взаємодії з передачею частини енергії. Це також приводить до втрати енергії і зменшення інтенсивності флуоресценції. Окрім цього, при зближенні молекул виникає можливість взаємодії їх між собою і з молекулами розчинника з утворенням складних асоціатів, що не володіють здатністю флуоресціювати. Інтенсивність флуоресценції сильно залежить від температури. Підвищення температури приводить до зменшення інтенсивності флуоресценції (рисунок 1.18, а), це явище називається температурним гасінням флуоресценції. Очевидно, що флуоресцентний метод аналізу слід проводити тільки при невисоких температурах. Температурне гасіння флуоресценції пояснюється тим, що з підвищенням температури збільшується коливальна енергія молекул і зростає кількість безвипромінювальних переходів. До цього ж приводить можлива температурна дисоціація молекул. Проте в деяких випадках з підвищенням температури інтенсивність флуоресценції може зрости в результаті утворення нових модифікацій молекул, що володіють вищою здатністю флуоресціювати.
Рисунок 1.18 – Залежність виходу флуоресценції від температури (а) і рН (б)
Інтенсивність флуоресценції і її забарвлення залежать також від рН розчину. Загальних закономірностей для цієї залежності привести не можна. Для деяких флуоресціюючих речовин із збільшенням рН вихід флуоресценції падає (рисунок 1.18, б, крива 1). Для інших – підвищується (крива 2). Для флуоресцентних індикаторів флуоресценція виникає тільки в певному інтервалі значень рН (крива 3). Для багатьох речовин із зміною реакції середовища змінюється і спектральна характеристика флуоресціюючої речовини (рисунок 1.19).
Рисунок 1.19 – Залежність спектральної характеристики флуоресценції від рН: 1 – кисле середовище; 2 – лужне середовище
У багатьох випадках інтенсивність флуоресценції залежить від присутності в розчині сторонніх речовин. Ряд речовин здатний гасити флуоресценцію, і в їх присутності інтенсивність її падає. Наприклад, бісульфіт натрію, тіосульфат натрію, перманганат калія та інші речовини здатні гасити флуоресценцію резоруфіна. Деякі речовини, навпаки, здатні викликати посилення флуоресценції. Так діють на флуоресценцію хініну добавки сульфатів. Гасіння флуоресценції сторонніми речовинами може бути пов'язане як з хімічними, так і з фізичними процесами. При хімічному гасінні флуоресціююча молекула вступає у взаємодію із сторонньою речовиною, утворюючи нефлуоресціюючу сполуку. Одним з таких гасителів є кисень, при окисленні яким утворюються нефлуоресціюючий продукти. Тому часто при стоянні речовини на повітрі його флуоресценція поступово зменшується. В деяких випадках здатність ряду металів давати з флуоресціюючими органічними молекулами нефлуоресціюючі комплекси, тобто пригнічувати флуоресценцію огранічної речовини, використовується в аналітичних цілях для визначення цих металів.
а, в – спектральні характеристики флуоресціюючої і погасаючої речовини; б, г – гасіння флуоресценції залежно від концентрації погасаючої речовини.
Рисунок 1.20 – Гасіння флуоресценції
При фізичному гасінні флуоресценції відбувається передача частини енергії збудженої молекули в результаті безвипромінювальних переходів молекулам сторонньої речовини і зниження у зв'язку з цим інтенсивності флуоресценції. При цьому, залежно від спектру погасаючої речовини, можуть виникнути резонансні і нерезонансні гасіння. У тих випадках, коли спектри флуоресціюючої речовини і погасаючої речовини (рисунок 1.20, а) майже співпадають, відбувається сильне гасіння флуоресценції. Навіть невеликі добавки такої речовини різко знижують інтенсивність флуоресценції (рисунок 1.20, б). Якщо спектри погасаючої речовини і що флуоресціює сильно відрізняються один від одного (рисунок 1.20, в), то в цьому випадку обмін енергіями відбувається менш інтенсивно і вплив на інтенсивність флуоресценції значно менший (рисунок 1.20, г). Гасіння сторонніми речовинами характеризується відношенням виходу флуоресценції без гасіння до виходу з гасінням В0/В. Чим інтенсивніше гасіння, тим це відношення більше. При проведенні флуоресцентних досліджень, особливо кількісних, необхідно стежити за вмістом в розчині сторонніх речовин, здатних змінювати інтенсивність флуоресценції. Час флуоресценції розчину зазвичай дуже великий; флуоресценція зникає зразу ж після видалення джерела збудження. Спектральні криві флуоресценції, яку називають поляризованим світлом, залежать від природи речовини, а іноді дають можливість достатньо чітко ідентифікувати речовини з близькими спектрами поглинання. В складних випадках спектр поляризації флуоресценції часто дозволяє точніше ідентифікувати речовини. Як і вихід флуоресценції, ступінь поляризації флуоресценції залежить від рН, температури, концентрації флуоресціюючої речовини. На відміну від виходу флуоресценції, який завжди падає із збільшенням температури, залежність ступеня поляризації флуоресценції від температури носить складніший характер і залежить ще і від концентрації. Не дивлячись на те, що між ступенем поляризації флуоресценції і концентрацією, як і для виходу флуоресценції на певному інтервалі концентрацій, існує прямолінійна залежність, вона для аналітичних цілей використовується порівняно рідко. Практичного застосування поляризація флуоресценції поки ще не знайшла.
В аналітичній хімії крім фотолюмінесцентних методів використовуються хемілюмінесцентні методи і, в першу чергу, хемілюмінесцентні індикатори. При хемілюмінесценції атом або молекула збуджуються за рахунок хімічної реакції, зазвичай окислення. Після цього збуджений атом, як це було описано вище, випромінює поглинену енергію свічення.
Викладені вище за закономірність в повній мірі відносяться до явища свічення кристалів – рекомбінаційного свічення. Характер свічення, тобто спектральна характеристика кристалів, залежить від природи домішок (активаторів). У певних умовах між інтенсивністю випромінювання і концентрацією активатора існує лінійна залежність (рисунок 1.21). Використання рекомбінаційного свічення в аналітичних цілях більш обмежене, ніж застосування флуоресценції в розчинах.
Рисунок 1.21 – Залежність інтенсивності флуоресценції від концентрації активатора
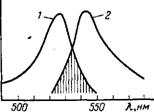
При проведенні кількісного флуоресцентного аналізу необхідно зважати на характер кривих поглинання самого флуоресціюючого розчину. Для ряду розчинів ці криві дзеркально симетричні. Залежно від природи речовини криві поглинання і флуоресценції можуть розташовуватися ізольовано або перекривати один одного (рисунок 1.22).
а – розчин антрацену в діоксані; б – лужний розчин флуоресцеїну.
Рисунок 1.22 – Спектральні криві поглинання (1) і флуоресценції (2) для деяких речовин
Флуоресцентний метод може бути використаний для прямого і непрямого аналізу. Прямі визначення ведуть безпосередньо по флуоресценції досліджуваного об'єкту. Необхідно відмітити, що серед неорганічних речовин дуже мало речовин, здатних флуоресціювати самостійно. До таких речовин належать сполуки урану і рідкоземельних елементів – церію, європію, самарії і інші. Значно частіше зустрічаються флуоресціюючі органічні речовини, наприклад резорцин, хінін, морфін і багато інших.
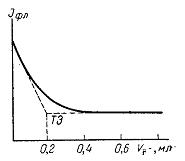
У непрямому флуоресцентному аналізі флуоресценція служить індикатором, який вказує закінчення процесу визначення даного іона або речовини. Флуоресцентні індикатори знаходять застосування майже у всіх методах об'ємного аналізу. Флуоресцентні індикатори можуть бути застосовані і в методі окисно-відновного титрування внаслідок властивостей деяких речовин флуоресценціювати лише в окисній чи відновній формі. При титруванні сульфатом церію іонів заліза (II) у присутності силоксену флуоресценція розчину, навпаки, зникає після додавання надлишку окислювача. При окисно-відновних титруваннях застосовуються також хемілюмінесцентні індикатори. Наприклад, люмінол в лужному розчині не люмінесціює, а під впливом окислювачів – КМn04, К2Cr2O7 і інших – виникає хемілюмінесценція окисленої форми продукту зеленого кольору. Особливо яскрава хемілюмінесценція виникає у присутності деяких каталізаторів. Оскільки виникнення хемілюмінесценції відбувається в певному інтервалі рН, ці індикатори можуть бути також використані для титрувань за методом нейтралізації. Застосування адсорбційних флуоресцентних індикаторів в методі осадження значно підвищує точність визначення точки еквівалентності. Так, якщо до розчину нітрату срібла додати флуоресцин, виникає яскрава зелена флуоресценція. При додаванні до розчину невеликих кількостей хлориду флуоресценція зникає, оскільки флуоресцин адсорбується осадом хлориду срібла. Перші краплі розчину хлориду, додані після досягнення точки еквівалентності, викликають перезарядження частинок хлориду срібла, флуоресцин десорбується, і в розчині знову виникає яскрава флуоресценція. В аргентометрії можуть бути застосовані флуоресцентні індикатори: еозин, родамін, флоксин та інші. У меркуриметрії можуть бути використані умбеліферон, хінінсульфат та інші. У комплексонометричному титруванні використовуються флуоресцентні індикатори, що дають з визначуваним іоном флуоресціюючі сполуки, що руйнуються комплексоном. В цьому випадку в точці еквівалентності спостерігається гасіння флуоресценції. Так, флуорексон з іонами кальцію в лужному середовищі дає сполуку, що флуоресціює жовто-зеленим кольором. У міру скріплення іонів кальцію комплексоном флуоресценція слабшає і в точці еквівалентності зникає. Флуоресцентні індикатори володіють рядом переваг в порівнянні із звичайними індикаторами. Перш за все, користуючись ними, можна титрувати непрозорі або забарвлені розчини. Ці індикатори для методу нейтралізації володіють вужчим, ніж інші індикатори, інтервалом переходу забарвлення, що у багатьох випадках буває дуже цінним. Для непрямого флуоресцентного визначення може бути використане описане вище гасіння флуоресценції. В цьому випадку кінець титрування визначається по кривій ослаблення флуоресценції. На рисунку 1.23 приведена крива титрування флуоресціюючого цирконій-моринового комплексу іонами фтору. При цьому в результаті реакції
флуоресціюючий комплекс цирконію з морином перетворюється на нефлуоресціюючий комплекс цирконію з фтором і слабо флуоресціюючий залишок морина.
Рисунок 1.23 – Крива флуоресцентного титрування
Останнім часом в практиці флуоресцентного аналізу почали застосовуватися кристалофосфори. Як основа застосовуються CаO, CaS04, NаF та інші тугоплавкі сполуки. При додавання в ці сполуки активаторів (солей або оксидів заліза, талія та інших) і обробці нагріванням або опромінюванням ультрафіолетовими променями виникає фосфоресценція, інтенсивність якої пропорційна змісту активатора. Чутливість таких визначень для деяких іонів дуже велика. Правда, визначення з використанні кристалофосфорів вимагають значно більше часу, чим з використанням флуоресцентних реакцій, оскільки отримання кристалофосфорів пов'язане з дуже тонким подрібненням, перемішуванням і сплавом. Широкого застосування цей метод поки не знайшов.
Висновки до розділу 1:
Суть фізико-хімічного аналізу полягає у вивченні співвідношень між складом і властивостями хімічних рівноважних систем. Результати подібних досліджень виражаються в діаграмах «склад – властивість». До оптичних методів аналізу відносять фізико-хімічні методи, засновані на взаємодії електромагнітного випромінювання з речовиною: · Фотометричні методи · Рефрактометричний метод · Поляриметричний метод · Люмінесцентний метод · Спектральний метод Метод аналізу, заснований на переведенні визначуваного компоненту в сполуки з подальшим визначенням кількості цього компоненту, що поглинає світло, шляхом вимірювання світлопоглинання розчину отриманої сполуки, називається фотометричним. Нефелометричним методом аналізу (нефелометрією) називають метод, заснований на вимірюванні інтенсивності світлового потоку, розсіяного твердими частинками, що знаходяться в розчині в зваженому стані. Турбідиметричним методом аналізу (турбідиметрією) називають метод, заснований на вимірюванні інтенсивності потоку, що пройшов через розчин, що містить зважені частинки. Інтенсивність зменшується унаслідок поглинання і розсіяння світлового потоку. Рефрактометричні методи аналізу засновані на визначенні показника (коефіцієнта) заломлення досліджуваної речовини. Поляриметричний метод аналізу заснований на вимірюванні кута обертання площини поляризації променя світла, що пройшло через оптично активне середовище. У певних умовах поглинена атомами речовини енергія може виділятися у вигляді променистої енергії. Так, розжарене тіло випускає промені певних довжин хвиль. Деякі речовини володіють здатністю світитися «холодним світлом», яке називається люмінесцентним.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 370. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 .
.
 вимірюється в нефелометрії, а ослабленого світла
вимірюється в нефелометрії, а ослабленого світла  , що проходить, в турбідиметрії.
, що проходить, в турбідиметрії. ,
,
 і
і  – коефіцієнти заломлення частинок і середовища;
– коефіцієнти заломлення частинок і середовища; – довжина хвилі падаючого світла;
– довжина хвилі падаючого світла; — відстань до спостерігача;
— відстань до спостерігача; – кут, утворений падаючим і розсіяним світлом.
– кут, утворений падаючим і розсіяним світлом. ,
,
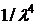 показує, що інтенсивність розсіяного світла швидко зростає із зменшенням довжини хвилі. Якщо аналізовану суспензію освітлюють білим світлом, то в результаті значного більшого розсіяння коротких хвиль розсіяне світло здається блакитним, тоді як світло, що проходить, має червонуватий відтінок.
показує, що інтенсивність розсіяного світла швидко зростає із зменшенням довжини хвилі. Якщо аналізовану суспензію освітлюють білим світлом, то в результаті значного більшого розсіяння коротких хвиль розсіяне світло здається блакитним, тоді як світло, що проходить, має червонуватий відтінок. ,
,
 – інтенсивність падаючого світлового потоку;
– інтенсивність падаючого світлового потоку;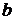 – товщина поглинаючого шару розчину;
– товщина поглинаючого шару розчину; – середній діаметр поглинаючих частинок;
– середній діаметр поглинаючих частинок; і
і 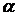 – константи, які залежать від природи суспензії і методу вимірювання;
– константи, які залежать від природи суспензії і методу вимірювання; .
.
 ,
,
 .
.
 .
.
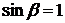 , отримуємо:
, отримуємо: ,
,
 – кут повного внутрішнього віддзеркалення.
– кут повного внутрішнього віддзеркалення. ,
,
 – швидкість розповсюдження світла в вакуумі;
– швидкість розповсюдження світла в вакуумі; – швидкість розповсюдження світла в даному середовищі.
– швидкість розповсюдження світла в даному середовищі.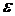 середовища рівнянням:
середовища рівнянням: .
.

 – криві для інфрачервоної області; 1 – крива показника заломлення; 2 – крива пропускання.
– криві для інфрачервоної області; 1 – крива показника заломлення; 2 – крива пропускання. , який відповідає більший довжині хвилі, значення
, який відповідає більший довжині хвилі, значення  ,
,
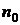 — показник заломлення за нормальних умов;
— показник заломлення за нормальних умов; — коефіцієнти, які залежать від природи газу;
— коефіцієнти, які залежать від природи газу;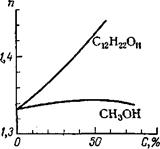


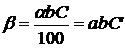
 ,
,
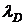 натрію і позначають
натрію і позначають 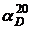 .
. ,
,  ,
,  існує ряд обертальних, таких, що коливають підрівнів
існує ряд обертальних, таких, що коливають підрівнів  ,
, 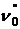 ,
,  ,
,  та інші (рисунок 1.13).
та інші (рисунок 1.13).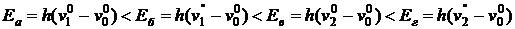 .
.

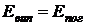 .
.
 .
.
 (перехід з, рисунок 1.13), то в цьому випадку
(перехід з, рисунок 1.13), то в цьому випадку
 .
.
 .
.
 на рівень
на рівень  за рахунок променевої енергії, потім з рівня
за рахунок променевої енергії, потім з рівня  за рахунок поглинання теплової енергії (перехід к, рисунок 1.13). В цьому випадку при зворотному переході з люмінесцентним випромінюванням (перехід л, рисунок 1.13)
за рахунок поглинання теплової енергії (перехід к, рисунок 1.13). В цьому випадку при зворотному переході з люмінесцентним випромінюванням (перехід л, рисунок 1.13) 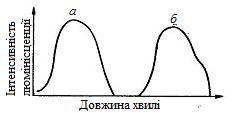


 .
.

 ,
,
 і
і  – середні довжини хвиль і частот відповідного енергетичного спектра.
– середні довжини хвиль і частот відповідного енергетичного спектра.

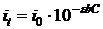
 ,
,