
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Результаты титрования запишите в таблицу № 2.1 ⇐ ПредыдущаяСтр 5 из 5 Запишите значения объёмов трилона Б и определите средний результат. Рассчитайте массу m1 ионов меди (II) до сорбции, используя исходную концентрацию ионов меди (II). Объем исходного раствора сульфата меди,
Рассчитайте концентрацию C2 ионов меди (II) после сорбции, используя закон стехиометрии:
где
Рассчитайте массу m2 ионов меди (II) в растворе после сорбции (объем раствора после сорбции практически не меняется, так как используется набухшая ионообменная смола (катионит).
где: Рассчитайте массу сорбированной меди m3 Результаты занесите в таблицу 2.1.
Таблица 2.1
Рассчитайте коэффициент распределения ионов меди (II)между жидкой (электролит) и твердой (катионит) фазой по формуле: Dтв/ж = m3/m2
Результаты опыта занесите в таблицу 2.2, используя результаты студентов группы.
Таблица 2.2
По результатам опыта сделайте вывод о зависимости коэффициента распределения Dтв/ж от времени контакта раствора с катионитом. 
Сорбция ионов никеля (II) на ионообменной смоле Выполнение опыта Сорбция ионов никеля (II) на катионите В стакан №1 налейте 40 мл раствора сульфата никеля с концентрацией 0,05 М. Объем раствора отмерьте мерным цилиндром или воспользуйтесь специальной меткой на стакане, которая соответствует объему в 40 мл. Отмерьте мерной ложечкой катионит КУ-2 (
По истечении заданного преподавателем времени сорбции аккуратно слейте с катионита раствор в стакан №2.
Определение концентрации ионов никеля (II) комплексонометрическим титрованием с мурексидом В полученном растворе определите концентрацию ионов никеля (II) комплексонометрическим титрованием с мурексидом. Для этого отберите пипеткой 10 мл раствора никеля из стакана № 2 и перенесите его в коническую колбу для титрования. В эту же колбу добавьте из бюретки 5 мл 10% раствора аммиакаи 1/2 мерной фарфоровой ложки индикаторамурексида. Смесь перемешайте и оттитруйте раствором трилона Б концентрацией 0,05 М до изменения окраски из желто-оранжевой в сиренево-малиновую в точке стехиометричности. Измерьте объем израсходованного на титрование раствора трилона Б. (Трилон Б – динатриевая соль этилендиаминтетрауксусной кислоты ЭДТА, C10H14O8N2Na2·2H2O, условная формула Na2H2Y). В реакции участвуют ионы – H2Y2-: Ni2+ + H2Y2- = NiY2- + 2H+ Титрование повторяют до получения не менее двух сходящихся результатов (±0,1 мл).
Оформление опыта Запишите значения объёмов трилона Б и определите средний результат. Рассчитайте массу m1 ионов никеля до сорбции, используя концентрацию исходного раствора сульфата никеля. Объем исходного раствора сульфата никеля равен 40 мл,
Рассчитайте концентрацию C2 ионов никеля в растворе после сорбции, используя закон стехиометрии:
где
Рассчитайте массу m2 ионов никеля в растворе после сорбции (объем раствора после сорбции практически не меняется,так как используется набухшая ионообменная смола (катионит).
где:
Рассчитайте массу сорбированногоникеля, m3 = m1 –m2
Результаты занесите в таблицу 3.1 Таблица 3.1
Рассчитайте коэффициент распределения ионов никеля между жидкой (электролит) и твердой (катионит) фазами по формуле: Dтв/ж = m3/m2 Результаты опыта занесите в таблицу 3.2, используя результаты студентов группы. Таблица 3.2
По результатам опыта сделайте вывод о зависимости коэффициента распределения Dтв/ж от времени контакта раствора с катионитом. КОНТРОЛЬНЫЕ ВОПРОСЫ: 1. На чем основан метод разделения меди и железа при взаимодействии с аммиаком? Предложите другой способ разделения меди и железа. 2. На чем основаны фотометрические методы определения концентрации окрашенныхрастворов? Запишите закон Бугера-Ламберта-Бера.
5. Какие растворы называют стандартными? 6. Что такое «холостая проба» в методе фотоколориметрического определения? 7. Запишите закон стехиометрии. Дайте определение точки стехиометричности (эквивалентности).
10. Приведите примеры применения методов разделения и очистки химических соединений в атомной энергетике.
Вопросы для защиты лабораторной работы «Методы разделения и очистки химических соединений» 1. При ионообменной очистке воды примеси токсичных элементов удаляют с помощью … 2. Напишите уравнения реакций, которые можно использовать для разделения смеси растворов сульфатов двух химических элементов с атомными номерами: 29 и 92 3. Напишите реакцию сорбции на катионите: |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 162. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 = 40 мл.
= 40 мл. =
=  ∙
∙  ,г
,г ∙
∙  = Стрилон Б ∙Vтрилон Б,
= Стрилон Б ∙Vтрилон Б, , моль/л
, моль/л =
=  ∙
∙  40 мл.
40 мл. ∙
∙  = Стрилон Б ∙Vтрилон Б
= Стрилон Б ∙Vтрилон Б
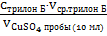
 г
m3 – масса сорбированных катионов меди(II)
m3 = m1 –m2
г
m3 – масса сорбированных катионов меди(II)
m3 = m1 –m2
 мг
мг
 – сульфокислота) и перенесите его в стакан с 40 мл раствора NiSO4. Включите секундомер, как только смола будет перенесена в стакан с раствором NiSO4. и непрерывно перемешивайте раствор стеклянной палочкой в течение заданного преподавателем времени. Перемешивание обеспечивает равномерную сорбцию катионитом ионов никеля(II) из раствора.
– сульфокислота) и перенесите его в стакан с 40 мл раствора NiSO4. Включите секундомер, как только смола будет перенесена в стакан с раствором NiSO4. и непрерывно перемешивайте раствор стеклянной палочкой в течение заданного преподавателем времени. Перемешивание обеспечивает равномерную сорбцию катионитом ионов никеля(II) из раствора.
 = 40 мл.
= 40 мл. =
=  ∙
∙  ∙
∙ 
 ∙
∙  = Стрилон Б ∙Vтрилон Б,
= Стрилон Б ∙Vтрилон Б, – объем пробы, взятый на титрование, 10 мл;
– объем пробы, взятый на титрование, 10 мл; , моль/л
, моль/л =
=  ∙
∙  = 40 мл;
= 40 мл;
 ∙
∙ 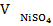 мл
мл
 мг
мг