
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Очистка и разделение химических соединений методом ионообменной сорбцииДля разделения и очистки широко используется метод ионного обмена, который основан на обратимой реакции обмена одноименными ионами между твердым катионитом
СuSO4 + 2 СuSO4 + 2 Сорбция ионов меди (II) на ионообменной смоле Выполнение опыта
Сорбция ионов меди (II) на катионите В стакан №1 налейте 40 мл раствора сульфата меди (II) с концентрацией 0,05 М. Объем раствора отмерьте мерным цилиндром или воспользуйтесь специальной меткой на стакане, которая соответствует объему в 40 мл. Отмерьте мерной ложечкой катионит КУ-2 (
Далее аккуратно слейте с катионита раствор в стакан № 2. В полученном растворе определите концентрацию ионов меди (II)комплексонометрическим титрованием с мурексидом. Определение концентрации ионов меди (II) комплексонометрическим титрованием с мурексидом Отберите пипеткой 10 мл раствора меди (II) из стакана № 2 и перенесите его в коническую колбу для титрования. В эту же колбу добавьте из бюретки 5 мл ацетатного буферного раствора и 1/2 мерной фарфоровой ложки индикатора – мурексида. Смесь перемешайте и оттитруйте раствором трилона Б концентрацией 0,05 М до изменения окраски из желто-оранжевой в сиренево-малиновую в точке стехиометричности. Измерьте объем израсходованного на титрование раствора трилона Б (Трилон Б – динатриевая соль этилендиаминтетрауксусной кислоты ЭДТА, C10H14O8N2Na2·2H2O, условная формула Na2H2Y). В реакции участвуют ионы – H2Y2-: 
Сu2+ + H2Y2- = CuY2- + 2H+ Титрование повторяют до получения не менее двух сходящихся результатов (±0,1 мл).
Оформление опыта |
||||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 178. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 или анионитом
или анионитом 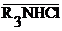 и жидким электролитом.
и жидким электролитом.

