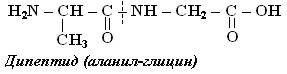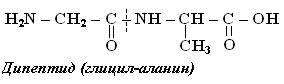Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Гипоксантин, 6-гидроксипурин 6 страницаБелоктар
Белоктар – барлық жан-жануарлар организмдерінің ең негізгі құрамдық бөлігі, яғни белок жоқ жерде тіршілік жоқ деуге болады. Негізінде белоктар аминқышқылдарынан тұратын жоғарғы молекулалы биологиялық полимерлер. Белоктардың түрі де, организмде атқаратын қызметі де өте көп. Белоктар бұлшық еттердің, қанның, сүттің, өсімдіктердің, жұмыртқаның, жүннің, табиғи жібектердің, шаштың құрамына кіреді. Төменгі кестеде адамның әртүрлі мүшелерінде болатын белоктардың шамасы келтірілген.
Әртүрлі органдардың тканіндегі белоктың мөлшері
Белоктардың атқаратын қызметінің ең маңыздыларына құрамдық, каталитикалық, тағамдық, тасығыштық (транспорттық), қорғау, реттеу, электр тасығыш функциялары жатады. Бұл функциялардан басқа да белоктардың атқаратын қызметі аз емес. Белоктар барлық өсімдік пен жан-жануарлар клеткаларының протоплазмасын және ядросын құратын құрылыс материал болып есептелінеді. Организмде жүретін метоболизм процестерінің жылдамдығын және бағытын реттеп отыратын биокатализаторлар – ферменттер де және гармондар да белоктар. Организм тіршілігіне керекті компоненттерді белгілі мүшелерге тасымалдаушы да, улы қосылыстардың әсерін төмендетуші де, энергия көзі де, тағамдық зат ретінде де белоктар өте қажетті заттар. Ф.Энгельс айтқандай «тіршілік дегеніміз – белокты дененің өмір сүру әдісі», яғни тіршіліктің негізгі нышаны – белоктар.  Табиғатта белоктардың көптеген түрлері кездеседі. Атқаратын функцияларына және қасиеттеріне байланысты олардың молекулалық массалары да әртүрлі келеді. Белоктардың молекулалық массалары бірнеше мыңнан бірнеше миллионға дейін болады. Мысалы, сүттегі альбуминнің молекулалық массасы 17400, қандағы белоктың массасы – 400000. белоктардың элементтік құрамы тұрақсыз. Барлық белоктардың химиялық құрамы шамамен мынадай: С–50-55%, Н–6,5-7,3%, О–21,5-23,5%, N–15-18%, S–0,2-2,4%, Р–0,8%-ке дейін, Ғе–0,4%. Соңғы кезде белоктың құрамында басқа да элементтер (магний, кобальт, сынап, күміс, қорғасын, иод, мыс, т.б.) болатыны анықталды. Белоктардың қасиеттері олардың организмде атқаратын қызметіне байланысты. Мысалы, ұлпалардағы (тері, сіңір, бұлшық ет және т.б.), тырнақтағы, шаштағы белоктар суда ерімейді, ал керісінше метаболизм процестеріне (мысалы, қан плазмасындағы белоктар) қатысатын белоктар суда немесе тұздардың сулы ерітінділерінде жақсы ериді. Белоктар ерігенде коллоидты ерітінді түзеді және олардың оптикалық пәрменді қасиеті бар. Белоктарды қышқылдармен немесе сілтілермен қыздырғанда олар гидролиз процесіне ұшырайды. Бұл процесте шығатын аралық заттарды яғни полипептидтердің қоспасын пептон деп атайды. Гидролиз толық жүргенде пептондардан жай полипептидтер, дипептидтер, содан кейін a-аминқышқылдары түзіледі. Негізінде организмде әртүрлі биохимия-лық реакциялар жүргенде жұмсалатын белоктар емес гидролиз нәтижесінде түзілген a-аминқышқылдары. Белоктардағы a-аминқыш-қылдарының саны 20.
Белоктың құрамына кіретін аминқышқылдары
Полипептидтік тізбегінде бос карбоксил және амин топтары болғандықтан белоктардың аминқышқылдары тәріздес амфотерлік қасиеті бар. Олар қышқылдармен де, негіздермен де тұздар түзеді. Қышқылды ортада карбоксил топтарының диссоциациялануы басылады, сондықтан белок оң зарядталады; ал негіздік ортада теріс зарядталады, себебі барлық карбоксил топтар диссциацияланады.
Осыған орай белок ерітіндісі арқылы электр тоғын жіберетін болсақ, онда сілті ерітіндісінде белок молекуласы анодқа, ал қышқылда катодқа қарай жылжиды. Белоктарды ерітінділерде тұнбаға түсіру. Белоктардың сулы ерітінділерінде минералдық тұздардың ерітінділерін (мысалы, аммоний сульфатын) қоссақ белоктар тұнбаға түседі. Белок ерітінділеріне органикалық еріткіштерді (спирт, айетонды) енгізгенде де олар тұнбаға өздерінің құрылысын өзгертпей түседі. Егер тұнбаға түсірген тұздардан тазаланғаннан кейін немесе тұз ерітіндісін сұйылтқанда белок қайтадан ерісе бұл қайтымды тұндыру болады. Бұл әдісті белоктарды тазартуға және бір бірінен бөлуге пайдаланады. Қайтымды тұндыру мен қатар қайтымсыз тұндыру да бар. Белоктарды қайтымсыз тұндыру үшін аыр металдардың (мыс сульфаты, қорғасын ацетаты, сулема және т.б. тұздар) тұздары, қышқылдар (азот, сірке, үшхлорсірке, пикрин) қолданылады. Қайтымсыз тұндырғанда белоктардың құрылысы өзгеріп, қайтадан ерімейтін күйге айналады. Бұл процесті денатурация деп атайды. Мысалы, альбуминнің сулемамен әрекеттесу реакциясын келесі теңдеумен көрсетуге болады: Белоктардың түсті реакциялары. белоктарды айқындау немесе ашу үшін бірнеше түсті реакциялар қолданылады. 1. Бирует реакциясы.Бұл реакция белоктарда пептидтік байланыстың (–СО–NH–) барлығын дәлелдеуге қолданылады. Барлық белоктар сілтілі ортада мыстың тұздарымен (СuSO4) күлгін түс береді. Дәл осындай күлгін мыс сульфатының ерітіндісі сілтілі ортада бируетпен H2N–CO–NH–CO–NH2 реакцияға түскенде де пайда болады, реакцияның аты осыған байланысты шыққан. Бирует реакциясы: NH2–CO–NH2 + H–NH–CO–NH2 → NH2–CO–NH–CO–NH2 + NH3 Ксантопротеин реакциясы. Концентрлі азот қышқылымен белоктар сары түсті қосылыс береді, о,ан аммиакпен әсер етсек ол қызғылт сары түске айналады. Бұл реакция белоктың құрамындағы ароматты аминқышқылдарының нитрленіп нитроқосылыстар түзгенін көрсетеді. Осы реакциямен белоктың құрамында фенилаланин, тирозин, гистидин, триптофан аминқышқылдары бар екенін дәлелдейді. Миллон реакциясы. Азот қышқылы мен сынап нитратының қоспасымен белоктарды қыздырғанда олар қызыл қоңыр түске боялады. Бұл реакция белоктың құрамында фенол тобының, мысалы, тирозин аминқышқылының барлығын айқындайды. Нингидрин реакциясы. Бұл реакцияға белоктардағы a-аминқышқылдары түседі. Реакцияның нәтижесінде бөлініп шыққан аммиак пен тотықсызданған нингидрин бір-бірімен және екінші нингидрин молекуласымен конденсация реакциясына түсіп көк түсті зат түзеді.
Белоктардың жіктелуі
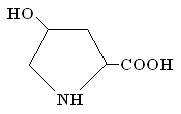
Барлық белоктар құрылысы және құрамы бойынша жіктеледі. Құрамына қарай екі үлкен топқа бөлінеді: қарапайым белоктарға немесе протеиндерге және күрделі белоктарға немесе протеидерге. Протеиндер гидролизденгенде тек аминқышқылдарына ыдырайды, басқа қосымша заттар шықпайды, ал протеидтер гидролизденгенде аминқышқылдарымен қатар әртүрлі заттар: көмірсулар, фосфор қышқылы, гетероциклды қосылыстар және т.с.с. түзіледі. Протеиндер. Ерігіштігіне байланысты бұлар да бірнеше топтарға бөлінеді. Альбуминдер – суда еритін белоктар, натрий хлоридінен басқа тұздардың қаныққан ерітінділерінде тұнбаға түседі. Қыздырғанда ұйыйды. Молекулалық массасы 30 бен 60 мыңның арасында. Альбуминнің өкілдері жұмыртқаның ағында, өсімдіктер дәнінде, ферменттерде, сүттің және қанның құрамында болады. Альбуминдерді кристалл түрінде алуға болады. Глобулиндер – суда ерімейтін, бірақ та тұзды ерітінділерде жақсы еритін белоктар. Олар қыздырғанда ұйыйды. Бұлардың көбісі кристалл түрінде алынған. Альбуминдермен салыстырғанда молекулалық массасы едәуір үлкен 90000-нан 1500000-ға дейін. Глобулиндерді бөліп алу үшін еріткіш ретінде натрий хлоридінің 10%-дық ерітіндісі қолданылады. Тұзды ерітіндіні сумен сұйылтып тұнбаға түскен глобулиндерді диализ әдісін қолданып тазалайды. Глобулиндер бұлшық ет талшықтарының, жұмыртқаның, сүттің, қанның, бұршақ тұқымдас өсімдіктер мен майлы дақылдардың құрамына кіреді. Кейбір γ-глобулиндер инфекциялық ауруларға қарсы дәрілік зат ретінде қолданылады. Проламиндер – 70-80%-дық спирт ерітіндісінде жақсы еритін, ал суда немесе сусыз спирттерге ерітмейтін белоктар. Бұл белоктардың аттары олар гидролизденгенде түзіліп шыққан пролин аминқышқылы мен аммиактан құралған. Проламиндер қайнатқанда ұйымайды. Өкілдері: бидай және қарабидай тұқымдарындағы – глиадин, арпа тұқымындағы – гордейн, жүгері дәніндегі – зеин, сұлыдағы – авенил. Глютелиндер – өсімдік текті белоктар, этил спиртінде және тұздардың нейтралды ерітінділерінде ерімейді, тек сұйытылған (0,2%) сілті ерітінділерінде ериді. Көбінде олар астық тұқымдастардың тұқымында кездеседі. Бұл белоктарды глютенин деп те атайды. Гистондар – сілтілік белоктар, олардың құрамында негіздік қасиеті қышқылдық қасиетке қарағанда жоғарылау диаминмонокарбон қышқылдары (лизин, аргинин) бар. Суда және сұйытылған қышқылдарда жақсы ериді, ал сілті ерітінділерінде ерімейді. Ең негізгі өкілдерінің бірі қанның күрделі белогі – гемоглобиннің құрамында болатын глобин. Гистондар нуклеин қышқылдарымен комплекстеніп дезоксирибонуклеотидтер түзеді. Протаминдер – негізінде негіздік қасиеті басымды аминқышқылдарынан (80%-ға дейін аргининнен, гистидиннен, лизиннен) тұратын белоктар. Бұлар белоктардың ішінде молекулалық массалары ең төмен белоктар (10000-нан аспайды). Суда, сұйытылған қышқылдардың және сілтілердің ерітінділерінде ериді. Протаминдердің өкілдері балық спермасында және күрделі белок – нуклеопротеидте кездеседі. Протеноидтар немесе склеропротеиндер. Құрамында едәуір мөлшерде күкірті болғандықтан бұл белоктардың қасиеттері басқа белоктармен салыстырғанда өзгеше келеді. Суда, тұзды ерітінділерде, сұйытылған қышқылдар мен сілтілерде ерімейді, тек ұзақ уақыт концентрлі қышқылдар және сілтілі ерітінділермен өңдегенде ғана ериді. Олар ас қорытатын ферменттердің әсерінен гидролизденбейді. Өсімдіктерде кездеспейді, тек жан-жануарлардың организмінде болады. Мысалы, олардың өкілдері: фибрион-жібекте; кератин-шашта, жүнде, мүйізде; эластин – қан тамырларының қабыршығында, сіңірде; коллаген – теріде, сүйекте, сіңірде, тканьдерде, шеміршекте кездеседі. Протеноидтар көбінесе моноаминмонокарбон қышқылдарынан құралған. Глицин, пролин, цистин көп мөлшерде, ал фенилаланин, тирозин, триптофан, гистидин, метионин аз мөлшерде болады. Протеидтер. Құрамына кіретін белок емес заттардың табиғатына байланысты протеидтер бірнеше топтарға бөлінеді. Фосфопротеидтер – құрамында фосфор қышқылының қалдығы бар белоктар. Фосфор қышқылының қалдығы белок молекуласындағы треонин мен серин аминқышқылдарының гидроксил топтарымен күрделі эфирлік байланыспен жалғасқан. Қыздырғанда ұйымайды, тек қышқыл ерітіндісінде ұйыйды. Маңызды өкілдері: сиыр сүтіндегі – казеин, жұмыртқаның сарысындағы – вителлин, балықтағы – ихтулин. Нуклеопротеидтер – құрамына нуклеин қышқылы мен жай белоктардың кейбір өкілдері (гистин немесе протамин) кіретін белоктар. Сілтілерде ериді, ал қышқылдарда ерімейді. Протоплазманың, клетка ядросының құрамында болады. Бұлардың организмнің тіршілік әрекетінде және тұқым қуалаушылық құбылыстарында атқаратын рөлі өте үлкен. Металлопротеидтер – қарапайым белоктар мен бояғыш заттардың, мысалы, гемоглабиннен, миоглабиннен, хлорофилден, тұратын белоктар. Молекулалық массалары 65000 шамасында. Омыртқалы жануарлардың қанындағы эритроциттерде болатын металлопртеидтердің өкілінің бірі гемоглабин негізінде глобин белогынан (96%) және темір атомы бар гем тобынан (4%) құралған. Глобинде төрт полипептид тізбегі бар. Оның екеуі a-аминқышқыл-дарынан, ал қалғаны β-аминқышқылдарынан түзілген. Әр тізбекке шамамен 140-тай аминқышқылдарының қалдықтары кіреді. Ал глобинмен байланысқан гем тобы порфин деп аталатын төрт пиррол қалдығанан тұрады. Кейбір омыртқасыз жануарлардың қанында гемоцианин болады, гемоглабиннен айырмашылығы мұнда темірдің орнында мыс болады. Бұлшық еттерде оттегі қорын сақтайтын құрылысы гемоглабиндікіне ұқсас миоглобиндер болады. Глюкопротеидтер – гидролизденгенде қарапайым белоктармен қатар көмірсуларына ыдырайтын белоктар. Бұлар суда ерімейді, сұйытылған сілтілерде ериді, қызыдырғанда ұйымайды. Организмде атқаратын қызметі өте зор. Негізінде олар сілекейде (муцин) кездеседі. Қанның плазмасында глюкопротеидтердің тағы бір өкілдері фибриноген және γ-глобулин кездеседі. Олар өсімдіктерде де және микроорганизмдерде де болады. Липопротеидтер – жай белоктармен липидтердің комплексті қосылыстары. Суда ерімейді. Бұлар сүтте, жұмыртқаның сарысында және де жан-жануарлардың әртүрлі мүшелері мен тканьдерінде болады. Белокты заттар молекулаларының түріне қарай да екі топқа жіктеледі: фибриллярлық (талшықты) белоктар, молекулалары жіп тәріздес келеді. Фибриллярлық белоктарға кератин (шашта, жүнде, тырнақта, қауырсында, мүйізде), коллаген (сіңірде, бұлшық етте), элсастин (қан тамырлары мен сіңірде), фибрион (жібекте) жатады; глобулярлық белоктардың молекулалары домалақ, үш өлшемді болып келеді; мысалы, оларға альбуминдер, глобулиндер, күрделі белоктар жатады. Белоктардың құрылысы Аминқышқылдардың молекулалары белоктарда бір-бірімен амидтік байланыс арқылы біріккен. Бұл байланысты пептидтік байланыс деп атайды, ал бірнеше амин қышқылдарының бірігуінен шыққан қосылыстарды пептидтер деп атайды. Егерде біріккен аминқышқылдарының саны 100-ге дейін болса пептидтерге жатқызады да, ал 100-ден асса белок деп санайды. Пептидтердің өзі төменгі молекулалық пептидтерге немесе олигопептидтерге (біріккен аминқышқылдарының саны 10-нан аспайды) және полипептидтерге бөлінеді. Пептидтердің немесе белоктардың макромолекулалары a-амин-қышқылдарының поликонденсация реакциясының нәтижесінде түзіледі: Мысалы:
Пептидтердегі және белоктардағы полиамидті тізбектің құрылысы бірдей, тек олардың бір-бірінен айырмашылығы аминқышқылдарының санында, яғни молекулалық салмақтарында. Бұлардың молекулалық салмақтарын анықтауға әртүрлі физикалық және химиялық әдістер қолданылады. Ең қарапайым химиялық әдістің бірі олардың құрамына кіретін ерекшелігі бар химиялық элементтің мөлшерін анықтау арқылы табу. Мысалы, гемоглабинде темірдің мөлшері 0,08%. Ал оның бір молекуласында темір атомының саны бірден төмен болуға тиіс емес, сондықтан гемоглабиннің молекулалық массасы 70 мыңдай келеді. Пептидтердің де, белоктардың да молекулалық массалары олардың құрамына кіретін аминқышқылдарының санына және түрлеріне байланысты келеді. Қазіргі кезде пептидтердің және белоктардың құрамына кіретін аминқышқылдарының табиғаты мен мөлшерін анықтауға кеңінен қолданылып жүрген әдістердің бірі хроматография. Аминқышқылдары әртүрлі кезекпен байланысатын болғандықтан пептидтермен белоктардың изомерлерінің саны өте көп болады. Мысалы, аланин мен глициннен құралған дипептидтің өзінде 2 изомер, ал осы 2 қышқылдан құралған трипептидте 6 изомер, тетрапептидте 14 изомер болады. Пептидтерді атағанда карбоксил тобында гидроксил тобы жоқ амин қышқылының қалдығын атау үшін -ин деген жалғау -ил мен ауысады. Мысалы, глицин – қалдығы глицил, аланин – қалдығы аланил. Төменде түсінікті болу үшін кейбір пептидтердің аттары берілген. Аланин мен глициннен тұратын үшпептидтер былай аталады:
аланил-аланил-глицин глицил-глицил-аланин аланил-глицил-аланин глицил-аланил-глицин глицил-аланил-аланин аланил-глицил-глицин
20 шақты әртүрлі аминқышқылдарынан (амин қышқылдары бір рет қана қайталанған) тұратын белоктың өзінде 2,3×108 изомерлері болады. Әртүрлі тәсілмен қосылуына байланысты 1000 аминқышқылдарының қалдықтарынан тұратын белоктың есеп бойынша 201000 изомері болуы мүмкін. Негізінде белоктардың табиғаты оның құрамына кіретін аминқышқылдарының түрімен қатар олардың бір-бірімен байланысу реттілігіне де тәуелді. Полипептидтік тізбектегі аминқышқылдарының байланысу реттілігі белоктардың бірінші құрылысын сипаттайды. Бірінші құрылымдағы аминқышқылдарының ретпен орналасуы әрбір белоктар үшін қайталанбайды. Әр жан-жануарлардың ерекше өзіне ғана тән белоктары болады. Мысалы, адамда және жануарларда болатын инсулин гармонындағы аминқышқылдарының кезектесу реті әр түрлі болып келеді. Ол екі жерден дисульфидтік көпіршемен байланысқан, бірінде 21 (А-тізбегі) екіншісінде 30 (Б-тізбегі) аминқышқылдарының қалдықтары бар екі тізбектен тұрады. Жан-жануарларда кездесетін айырмашылық 21 аминқышқылдарының қалдықтарынан құралған тізбектегі реттілікке байланысты, яғни бұл айырмашылық 8 бен 10-ның аралығындағы орындарда болады. Адам организміндегі инсулинде бұл орындарда Тре-Сер-Иле, бұқада Ала-Сер-Вал, шошқада Тре-Сер-Иле, жылқыда Тре-Гли-Иле, қойда Ала-Гли-Вал. Осымен қатар Б-тізбегінде де айырмашылық кездеседі; адам инсулинінде Б тізбегінің бір шеті треонин қалдығымен шектелсе, бұқа инсулиніндегі Б-тізбектің шетінде аланин қалдығы болады. Қазіргі кезде автоматты аспаптардың көмегімен бірнеше жүздеген белоктардың құрылысы анықталып отыр. Осыған орай кейбір тұқым қуалайтын аурулардың бастапқы себебі де анықталды. Мысалы, анемия (қан аздық) ауруларына шалдыққан адамдардың күрделі гемоглобин тізбегінде тек қана бір аминқышқылының екінші аминқышқылымен ауысқанына байланысты болып шықты. Осымен қатар басқа да көптеген қатерлі аурудың пайда болу себептері дәлелденіп отыр. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 1182. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||