
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Внутренняя энергия ТС является однозначной функцией ее состояния.
Пусть состояние ТС определяется набором независимых переменных - обобщенных ТД координат (x1,...xk,...), число которых равно числу степеней свободы ТС, или числу ее независимых взаимодействий с ОС. Согласно второму утверждению, для ТС можно записать полный дифференциал внутренней энергии
где Поскольку сумма внутренней энергии ТС U и энергии ОС Eосв соответствии с законом сохранения энергии остается неизменной (U + Eос = const), то каждая элементарная работа Xidxi соответствует определенному виду обменного взаимодействия ТС с ОС. Если в качестве обобщенных координат ТС рассматриваются ее объем V, площадь поверхности S, электрический заряд Qe, электростатическая (D) или магнитная (В) индукции, то соответствующими им обобщенными силами будут давление со знаком минус -p, поверхностное натяжение s, электрический потенциал j, напряженность электрического (Е) или магнитного (H) полей. Среди обменных взаимодействий ТС с ОС в термодинамике выделяется особо обмен теплотой и веществом. Пусть первый член суммы в (1.18) равен элементарному количеству теплоты dQ = X1dx1, сообщаемому ТС окружающей средой. Первый закон термодинамики не определяет свойственную теплоте обобщенную координату x1 и силу X1. Одна из переменных, например xk, может представлять число частиц N (или число молей), содержащихся в ТС. Парная этой координате обобщенная сила  Далее через -dL обозначим оставшуюся сумму механических и немеханических видов работы:
Знак минус перед dL означает, что положительной считается работа, совершаемая в направлении ТС ® ОС. В принятых обозначениях уравнение (1.14) приобретает аналитическую форму первого закона термодинамики:
Теплота и работа в отличие от внутренней энергии не являются функциями состояния, а представляют собой функции процесса, или функционалы, с чем и связано употребление знака вариации d в отличие от знака дифференциала d. Функционалом является и количество энергии, передаваемой ТС из ОС при обмене веществом.
Примечание. Первое начало термодинамики в форме, выражающей независимость изменения внутренней энергии от пути процесса, было открыто Г.И. Гессом (1840 г.) в результате анализа теплоты химических реакций. Принцип эквивалентности теплоты и работы был сформулирован в работах Ю. Майера (1841 г.), Д. Джоуля (1843 г.) и Г. Гельмгольца (1847 г.). Второй закон термодинамики Второй закон термодинамики констатирует необратимость всех естественных термодинамических процессов. Количественное выражение второго закона было получено на основании двух различных формулировок, предложенных Клаузиусом и Томсоном. Формулировку Томсона, после ее уточнения Планком, стали называть формулировкой Томсона ‑ Планка [1]. Формулировка Клаузиуса: невозможен процесс, единственный результат которого заключается в передаче тепла от тела менее нагретого телу более нагретому. Формулировка Томсона ‑ Планка: невозможен циклический процесс, единственными результатами которого являются охлаждение источника тепла и поднятие некоторого груза. Представленные формулировки второго закона термодинамики эквивалентны ‑ невозможность осуществления процесса Клаузиуса ведет к невозможности процесса Томсона ‑ Планка и наоборот. С использованием формулировок второго закона термодинамики доказывается теорема Карно: коэффициент полезного действия h обратимого цикла Карно зависит только от температур t1 и t2 нагревателя и холодильника и не зависит от конструкции машины и свойств рабочего тела:
В (1.20) Q1 и Q2 соответственно количества теплоты, полученные за цикл рабочим телом и холодильником; t1, t1 ‑ температуры нагревателя и холодильника, определенные по эмпирической шкале температур по некоторому термометрическому свойству.
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 199. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 , (1.18)
, (1.18) есть частные производные от внутренней энергии по обобщенным координатам, представляющие собой обобщенные ТД силы, а Xidxi есть элементарная работа силы Xi на перемещении dxi.
есть частные производные от внутренней энергии по обобщенным координатам, представляющие собой обобщенные ТД силы, а Xidxi есть элементарная работа силы Xi на перемещении dxi. , равная приращению внутренней энергии ТС при увеличении на единицу числа частиц (или молей) в ТС, называется химическим потенциалом.
, равная приращению внутренней энергии ТС при увеличении на единицу числа частиц (или молей) в ТС, называется химическим потенциалом.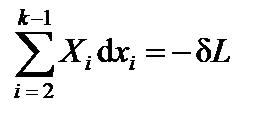 .
.  . (1.19)
. (1.19) . (1.20)
. (1.20)