
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Примечание. Здесь и далее под состоянием ТС понимается состояние ее ТД равновесия.Один моль однородного вещества можно представить как ТС с двумя степенями свободы. Его внутреннее состояние можно изменить путем независимого изменения двух внешних переменных: объема V и давления p. Согласно нулевому началу термодинамики, мерой состояния равновесия является температура Т. Поэтому между тремя интенсивными ТД переменными (p, V, T), которые принято называть термическими, должна существовать связь, описываемая уравнением вида
которое называется термическим уравнением состояния. Термическое уравнение состояния чаще записывается в форме
где роль независимых переменных играют V и T, а р рассматривается как функция состояния. Другие функции состояния для моля однородного вещества также определяются двумя независимыми ТД переменными. Например, уравнение, связывающее внутреннюю энергию U с независимыми ТД переменными (V, T), представляет собой калорическое уравнение состояния
Конкретный вид термического уравнения состояния строго установлен лишь для идеального газа:
где R = 8,314 Дж/(моль∙К) - универсальная газовая постоянная. Единицы измерения (p, v, T): [р] = Па = Н/м2, [v] = м3/моль, [Т] = К; Т ‑ абсолютная ТД температура. При описании поведения реальных газов часто используют уравнение состояния, полученное Ван дер Ваальсом:

где a и b ‑ эмпирические константы, характеризующие индивидуальное вещество.
Примечание. Для установления функциональной зависимости (1.7) понадобилось около 200 лет; при этом были использованы работы Р. Бойля (1661 г.), Э. Мариотта (1676 г.), Ж. Гей-Люссака (1801 г.), Б. Клайперона (1835 г.) и Д.И. Менделеева (1874 г.). Уравнение (1.8) предложено И. Ван дер Ваальсом в 1873 г. (Нобелевская премия 1910 г.). Оно имеет разнообразные практические приложения, в частности, позволяет обнаружить критическое состояние вещества.
Термодинамические коэффициенты Из самого факта существования термического уравнения состояния можно получить важные следствия. Действительно, рассматривая такие малые изменения состояния вещества, при которых фиксирована одна из ТД переменных, мы получаем четыре термических ТД коэффициента (изобарический коэффициент объемного термического расширения aр, изотермический и адиабатический (при dq = 0) коэффициенты всестороннего сжатия bT, bS и изохорический коэффициент упругости gV):
Нижние индексы при частных производных указывают ТД параметр процесса ‑ изобарического, изотермического или изохорического. Общее уравнение состояния (1.2) позволяет получить соотношение, связывающее коэффициенты aр, bТ и gV между собой:
Рассматривая изменение температуры dT при подводе к ТС элементарного количества тепла dq при фиксированном термодинамическом параметре процесса x, можно определить калорический термодинамический коэффициент ‑ теплоемкость Cx:
Особое место в термодинамике занимают теплоемкости Сp и СV, характеризующие свойства ТС в процессах теплообмена при постоянном давлении p и объеме V:
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 176. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 , (1.2)
, (1.2) , (1.3)
, (1.3) (1.4)
(1.4) (1.5)
(1.5) , (1.6)
, (1.6) ; (1.7a)
; (1.7a) ,
, 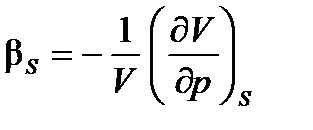 ; (1.7б, в)
; (1.7б, в) . (1.7г)
. (1.7г) . (1.8)
. (1.8) . (1.9)
. (1.9) ,
, 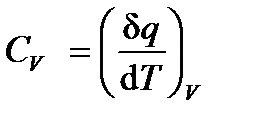 . (1.10а, б)
. (1.10а, б)