
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Обратимые и необратимые термодинамические процессы
Изменение состояния термодинамической системы представляет собой термодинамический процесс. Любой термодинамический процесс развивается в условиях отклонения термодинамической системы от состояний равновесия. Процесс, в котором все параметры системы меняются настолько медленно, что в системе в каждый момент времени состояние можно с большой точностью рассматривать как равновесное, представляет собой квазистатический, или равновесный процесс. Если состояние системы в каждый момент времени (или в некоторые из них) не являются состояниями равновесия, то ТС совершает неравновесный процесс. Неравновесный процесс характеризуется возникновением в ТС потоков теплоты, вещества, импульсов и т. п.; при равновесном процессе эти потоки равны нулю. В неравновесном состоянии внутренние параметры не определяются однозначно внешними условиями. Поэтому для характеристики неравновесного состояния необходимо кроме внешних условий задавать дополнительные параметры. Термодинамические процессы подразделяют на необратимые и обратимые. Рассмотрим ТС и ОС, составляющие изолированную систему, которые совершили процесс перехода из начальных состояний в конечные состояния в результате термодинамического взаимодействия. Возможен ли обратный процесс, возвращающий и ТС и ОС в их начальные состояния? Термодинамика, опираясь на эмпирические данные, отвечает на этот вопрос отрицательно. Все термодинамические процессы в рассматриваемой системе необратимы в большей или меньшей степени. Процессы, степень необратимости которых пренебрежимо мала, называются обратимыми. Приведем развернутую формулировку обратимости процесса.  Обратимым называют процесс, который может проходить в прямом и обратном направлениях и притом так, что при обратном процессе ТС при том же самом изменении внешних условий, но только в обратной последовательности, переходит от конечного состояния к начальному через все те же состояния, что и в прямом процессе. После завершения обратного процесса и ТС и окружающая среда возвращаются в начальные состояния. Обращение процесса возможно, когда произведенная в процессе работа достаточна для осуществления в полном объеме обратного процесса ‑ возвращения и ТС и ОС в начальное состояние. Сформулированному условию отвечают два элементарных процесса, проводимые квазистатически в отсутствии трения: изотермическое изменение объема при физически бесконечно малых разностях температур ТС и ОС и адиабатическое изменение объема. Цикл Карно, состоящий из таких изотермических и адиабатических расширений и сжатий, является обратимым.
Первый закон термодинамики Закон сохранения и превращения энергии является всеобщим законом природы, применимым ко всем явлениям и процессам. Согласно этому закону энергия изолированной системы, равная сумме всех видов энергии, имеющихся в системе, при любых происходящих в системе процессах не меняется: энергия не создается и не уничтожается. Пусть E есть общая энергия термодинамической системы, равная сумме кинетической Eк, потенциальной Eп и внутренней U энергий частей системы:
E = Eк + Eп + U. (1.11)
Согласно закону сохранения и превращения энергии полная энергия изолированной термодинамической системы не изменяется с течением времени, т. е. E = const, или
dE = 0. (1.12)
Для открытой ТС, обменивающейся с ОС теплотой dQ, работой dL и веществом dN, закон сохранения и превращения энергии ‑ первый закон термодинамики записывается в следующем виде
dE = d(Eк + Eп + U) = dQ ‑ dL + mdN, (1.13)
где m ‑ химический потенциал, характеризующий изменение энергии ТС при обмене веществом с ОС. Если в рассматриваемой ТС отсутствуют потоки вещества (dEк = 0), а приращением потенциальной энергии можно пренебречь (dEп = 0), то уравнение первого закона термодинамики для квазистатических процессов
dU = dQ ‑ dL + mdN (1.14)
устанавливает связь между приращением dU внутренней энергии ТС и энергиями термодинамических взаимодействий dQ, dL, mdN ТС и ОС. Внутренняя энергия является функцией состояния ТС. Рассмотрим циклический процесс, совершив который ТС возвращается в начальное состояние. Интегрируя
по линии цикла получим:
Вся совокупность данных о преобразовании теплоты в работу в циклических процессах приводит к заключению о равенстве теплоты, полученной ТС в циклическом процессе и произведенной ТС работы:
Из (1.17) следует
Следствием (1.17) является справедливость утверждения, что внутренняя энергия не зависит от траектории перехода ТС в данное состояние, т. е. является функцией состояния.
Рассмотрим термодинамическую систему, кинетическая и потенциальная энергии которой не изменяется при взаимодействии с окружающей средой. Справедливы следующие утверждения, являющиеся формулировками первого закона термодинамики:
1) произведенная в круговом, процессе работа ТС равна количеству подведенной к ней теплоты; |
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 199. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
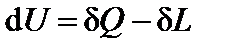
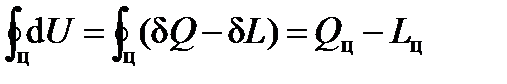 . (1.15)
. (1.15)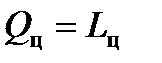 . (1.16)
. (1.16)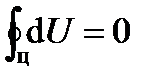 . (1.17)
. (1.17)