Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ОБСУЖДЕНИЯ ⇐ ПредыдущаяСтр 3 из 3 3.1 Выращивание ночной культуры На первом этапе работы посеяли клетки E.coliштаммов типа BL21(plys) содержащих плазмидуpET28a и клетки E.coliштаммов типа BL21(plys) содержащих плазмидуpGS21a на агаризную среду, добавив ампициллин до концентрации 50 мкг/мл и канамицина до концентрации 20 мкг/мл (клетки на чашку сеяли вечером и оставляли расти колонии в течение ночи при 37С˚) . Оставили расти клетки до утра. На следующий день в посеянных чашках Петри обнаружили видимые колонии округлой формы и различной величины.
3.2 Перенос вросшихся колоний На втором этапе работы взяли по одной колонии E.coli из двух чашек Петри на две донные колбы с жидкой средой LB (Рисунок 3.1) для того, чтобы выращиваемая колония росла быстрее и эффективнее. Чашку убрали на комнатную температуру, а потом поместили в холодильник (на 4 С˚). Оставили на качалке шейкер инкубаторе G737 для того, чтобы колонии росли равномерно. 12 часов потребовалось для достижения определенной плотности клеток в прекультуре .
Рисунок 3.1 - Колонии E.coli в жидкой LB-среде.
3.3 Выделение плазмидной ДНК После проведения первого центрифугирования при 3000 об\мин (g = 1509) в минуту в течении 20 минут при 4Со получили осадок на дне двух стаканчиков. После того как убрали над осадочную жидкость и провели второе центрифугирование при 3000 об\мин (g = 1509) в минуту в течении 1 минут при 4Со, мы получили еще осадок на дне стаканчиков, при котором отобрали остатки жидкости. Ресуспензировались после добавления растворов 1, 2 и ацетата аммония, которых после оставили на льду. После проведения третьего центрифугирования при 3000 об\мин (g = 1509) в минуту в течении 20 минут при 4Со получили осадок. Отобрали супернатант микропипеткой, разделили на две центрифужные стаканчики с добавлением по 5 мл изопропанола.  Центрифугировали четвертый раз при 3000 оборотов (g = 1509) в минуту при 4Со в течении 10 минут, при котором получили осадок и отбросили остатки жидкости. А осадок растворилась после добавления 2М ацетата аммония. Центрифугировали пятый раз при 10000 оборотов (g = 5590) в минуту комнатной температуре 10 минут и получили осадок. Супернатант перенесли в пробирку с равным объемом изопропанола. Оставили на столе на 10 минут. Центрифугировали шестой раз при 10000 оборотов (g = 5590) в минуту комнатной температуре 5 минут. При котором тоже получили осадок. В конце сполоснули осадок 70% раствором этанола. Таким образом на третьем этапе мы отделились от других структур и выделили смесь нуклеиновых кислот. 3.4 Определение степени чистоты образцов в спектрофотометре. При проведении анализа чистоты полученных образцов по выделению плазмидной ДНК в спектрофотометре GENESYS 10 получили данные оптической плотности в пределах длины волн от 200 до 300 нм. По полученным данным построили график и выявили частоту полученных плазмид в исследуемом образце. Таблица 3.1 - Первый образец E.collipGS21a с Ампицилином
График 3.1 - Первый образец E.colli с Ампицилином
Таблица 3.2 - Второй образец E.collipGS21a с Ампициллином
График 3.2 - Второй образец E.colli с Ампициллином
Таблица 3.3 - Первый образец E.collipET28a с Канамицином
График 3.3 - Первый образец E.collipET28a с Канамицином
Таблица 3.4 - Второй образец E.collipET28a с Канамицином
График 3.4 - Второй образец E.collipET28a с Канамицином По графикам видно что показатели оптической плотности в пределах с 235 нм до 280 нм равномерно повышается, что дают положительные результаты о наличии нуклеиновых кислот (в составе которых имеются и плазмиды). Для определения степени чистоты исследуемых образцов использовали формулы: 1. 260\235 нм 2. 260\280 нм 1. Первый образец E.colipGS21a с Ампициллином: (1)260\235= 2,38; (2)260\280= 2,14; 2. Второй образец E.colipGS21a с Ампициллином: (1)260\235= 2,49; (2)260\280= 1,95; 3. Первый образец E.colipET28a с Канамицином: (1)260\235= 2,33; (2)260\280= 2,13; 4. Второй образец E.colipET28a с Канамицином: (1)260\235= 2,3; (2)260\280= 2,1. По полученным данным о степени чистоты исследуемых образцов по формуле соответствуют пороговому значению.
Определили концентрацию по нанометру данных спектрофотометра. По которой 1 оптическая единица равна 50 мкг\мл. 1. Первый образец E.colipGS21a с Ампициллином 0,655 нм = 32,75 мкг\мл; 2. Второй образец E.colipGS21a с Ампициллином: 0,987 нм = 49,35 мкг\мл; 3. Первый образец E.colipET28a с Канамицином: 2,97 нм = 148,5 мкг\мл; 4. Второй образец E.colipET28a с Канамицином: 2,991 нм = 149,55 мкг\мл.
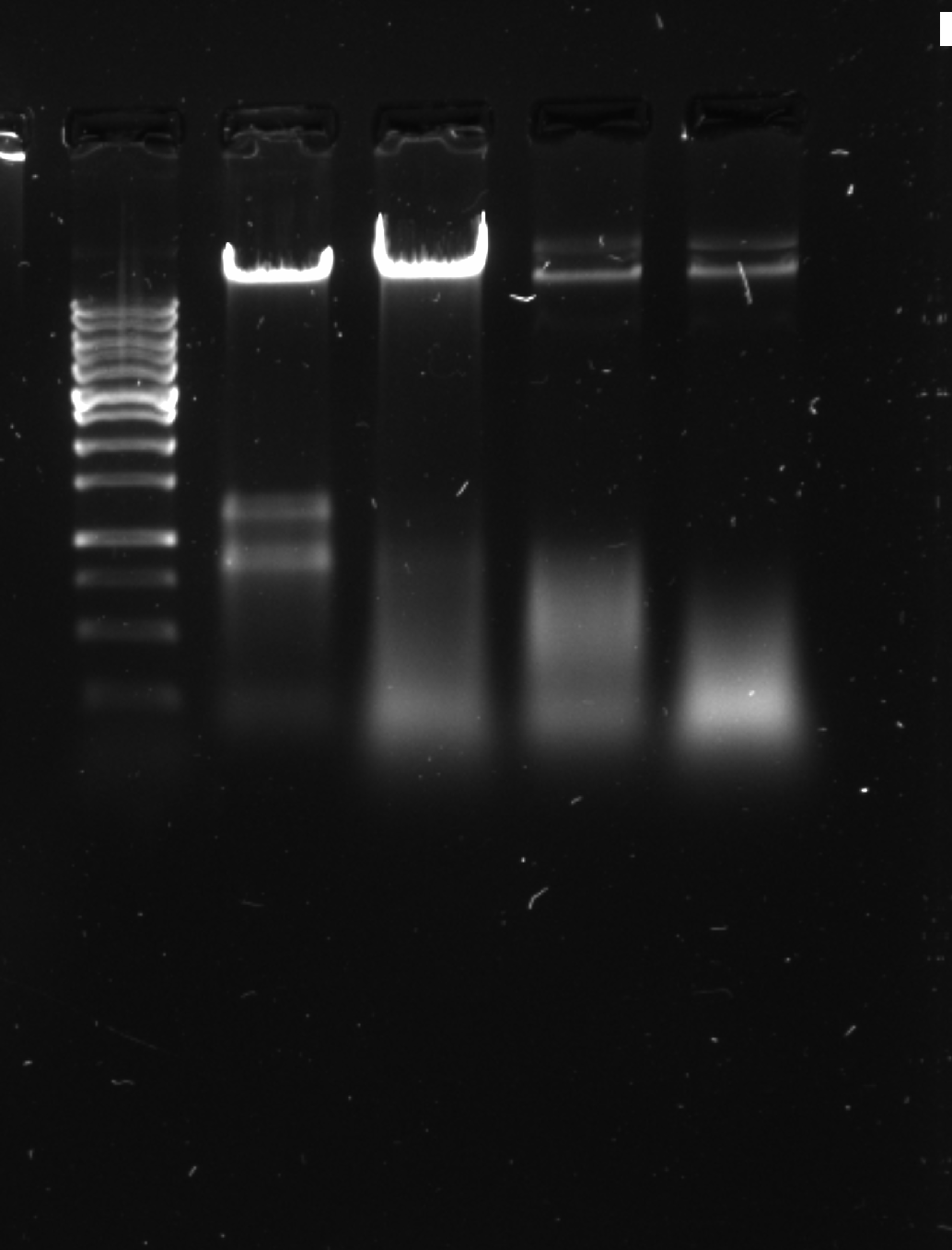
3.5 Анализ полученных образцов плазмидных ДНК с помощью электрофореза в агарозном геле Для точного выявления морфологических видов плазмид и наличию других остатков нуклеиновых кислот провели электрофоретический анализ с окрашиванием наших образцов раствором буфера ДНК Sky-Highв 1% агарозном геле. Провели электрофорез в течении 40 минут при напряжении 100 Вт. После проведения электрофореза исследуемые образцы проверили в ультрафиолетовом луче системы видео документации MolecularImagerGelDocXr.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 241. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |