Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Использованные микроорганизмы и плазмидыСтр 1 из 3Следующая ⇒ Министерство образования и науки РФ Федеральное государственное автономное образовательное учреждение высшего образования «КАЗАНСКИЙ (ПРИВОЛЖСКИЙ) ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ»
ИНСТИТУТ ФУНДАМЕНТАЛЬНОЙ МЕДИЦИНЫ И БИОЛОГИИ
КАФЕДРА БИОХИМИИ И БИОТЕХНОЛОГИИ Специальность: ЛЕЧЕБНОЕ ДЕЛО
Курсовая работа ВЫДЕЛЕНИЕ ПЛАЗМИДНОЙ ДНК ESCHERICHIA COLI.
Студент 4 курса Группа 01-413 «___»______________2018 г. _____________________ (Эргашев М.Б.) Преподаватель сотрудник кафедры биохимии и биотехнологии КФУ «___»______________2018 г.______________________(Изотова Е.Д.)
Казань – 2018 СОДЕРЖАНИЕ СПИСОК СОКРАЩЕНИЙ 3 ВВЕДЕНИЕ4 ОБЗОР ЛИТЕРАТУРЫ 5 1.1 Кишечная палочка 5 1.2 Плазмиды 6 1.2.2 История исследование плазмид 6 1.2.3 Классификация плазмид7 1.3 Метод выделения плазмид 16 1.4Количественное определение ДНК с помощью спектрофотометрии 17 1.5 Метод агарозного электрофореза ДНК. 17 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 15 2МАТЕРИАЛЫ И МЕТОДЫ 15 2.1 Оборудование 15 2.2 Использованные микроорганизмы и плазмиды 15  2.3 Использованные в работе растворы 15 2.4. Ход работы 16 2.4.1 Выращивание ночной культуры E.coli16 2.4.2 Перенос вросшихся колоний 16 2.4.3 Выделение плазмидной ДНК 17 Определение степени чистоты образцов в спектрофотометре 2.4.5 Анализ с помощью электрофореза в агарозном геле 3РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ 19 3.1Выращивание ночной культуры E.coli 3.2 Перенос вросшихся колоний 3.3 Определение степени чистоты образцов в спектрофотометре 3.4 Анализ с помощью электрофореза в агарозном геле ВЫВОДЫ 22 СПИСОКИСПОЛЬЗОВАННОЙЛИТЕРАТУРЫ 23
ОБЗОР ЛИТЕРАТУРЫ 1.1 Кишечная палочка Кишечная палочка (Escherichia coli) - это грамотрицательные палочковидные бактерии, принадлежащие к семейству Enterobacteriaceae, роду Escherichia (эшерихия). Названы в честь открывшего их в 1885 году немецкого ученого Т.Эшериха (T. Escherich).
1.2.1 Плазмида Плазмида – нехромосомный и в свою очередь самовоспроизводящийся генетический элемент, то есть является фактором наследственности бактерий и некоторых других организмов. Способны к автономному поддержанию в цитоплазме бактерий или существованию в интегрированном в хромосому состоянии, откуда они могут свободно выходить в цитоплазму (иногда с фрагментами хромосомы). Некоторые хромосомы могут распространяться в бактериальной популяции между ее членами. Плазмидные ДНК определяют ряд важных свойств бактерий: 1. Являются факторами фертильности – определяют донорский фенотип клетки; 2. Контролируют резистентность к антибиотикам, сульфаниламидам, катионам тяжелых металлов, бактериоцинам, бактериофагам, к сыворотке крови; 3. Образует чувствительность к бактериоцинам; 4. Синтез тиамина, пролина, внеклеточной ДНКазы и др.; 5. Синтез антибиотиков и бактериоцинов; 6. Метаболизм углеводов, углеводсодержащих соединений, галогеновых соединений, белков; 7. Фиксацию азота; 8. Продукцию токсинов, гемолизина, антигенов колонизации, капсулы.
1.2.2История исследования плазмид Первым плазмид исследовали в 1921 году Bourdet и Ciuca, которые открыли лизогенные бактерии, способные спонтанно лизироваться. А в 1925 году Gratia обнаружил фактор, подавляющий рост некоторых видов энтеробактерий, которую позже назвали “принцип V”. Wollman в 1928 г. высказал предположение о трансмиссивности факторов лизогенности. В 1932 г. Gratia идентифицировал обнаруженный им фактор, обладавший антагонистической активностью как белковоподобное вещество. Это исследование дало начало изучению колициногенности – способности бактерий E. Coli продуцировать колицины – вещества, подавляющие рост близкородственных бактерий. Основываясь на сходстве выражения бактериоциногенности и лизогенности бактерий, Fredericq (1946) высказал гипотезу об идентичности продуктов летального синтеза, определяющих названные свойства. Согласно его концепции, детерминанты синтеза колицинов представляют собой дефектный бактериофаг, сохранивший способность летального синтеза, но утративший гены, ответственные за формирование фаговых частиц. А в 1946 г. Д. Ледерберг и Э. Татум в своих трудах открыли конъюгацию бактерий. Которое в дальнейшем было доказано, что при конъюгации часть клеток являются донорами, а часть реципиентами, что зависит от присутствия внехромосомного фактора фертильности: F-фактора, откуда следовал вывод об односторонности механизма и наличия F+ и F — фенотипов. Дальнейшие исследования показали возможность превращения клеток F — в F+ в смесях клеток обоих типов, что указывало на трансмиссивность F-фактора. Было также доказано существование внехромосомных элементов – «плазмид». Как оказалось позднее, плазмида (фактор) F является чистым фактором генетического переноса, так как обладает лишь генами переноса и генами репликации. Внехромосомная природа фактора F была доказана на основании результатов обработки бактерий F+ акридиновыми красителями, что приводит к «удалению» фактора F из клеток популяции и превращает их из доноров в реципиентов (Hirota, Jidjima, 1956; Lederberg, 1958; Wollman, Jacob, 1956). Открытие во второй половине 50-х годов японскими исследователями генетических элементов, контролирующих множественную трансмиссивную устойчивость бактерий к наиболее широко применявшимся антибиотикам и синтетическим химиотерапевтическим препаратам сульфаниламидного ряда, ознаменовало новый этап в изучении внехромосомных факторов наследственности бактерий (Watanabe, 1963; Mitsuchashi, 1960, и др.). Она передавалась в результате клеточных контактов, независимо от переноса бактериальной хромосомы. Для обозначения детерминантов лекарственной резистентности Mitsuhashi S. предложил символ R. В России исследования плазмид были начаты в конце 50-х гг. в лабораториях Д. Г. Кудлай и А. П. Пехова.
1.2.3 Классификация плазмид Существует несколько систем классификации плазмид, базирующихся на: 1. Топологии (суперспирализованные, линейные или кольцевые); 2. Механизмах репликации; 3. Маркерных генах, содержащихся на плазмидах круге хозяев; 4. Копийности; 5. Конъюгативные (способные к переносу в другие клетки)/неконъюгативные; 6. Функции.
1.2.3.1 По топологии плазмид Плазмиды – молекулы ДНК, с размерами от 1 По морфологическому строению выделяют кольцевую, линейную и суперспирализованные формы (Рисунок 1.1). Молекуле плазмидной ДНК присущи различные конформации: может быть двух-цепочечная кольцевая форма (в результате смыкания одной из цепей ДНК – «релаксированная» форма), в результате смыкания обеих цепей образуется ковалентно закрытая сверхспиральная кольцевая форма.
Рисунок 1.1 - Конформацииплазмидной ДНК: 1) суперспирализованная, 2) линейная и 3) кольцевая релаксированная. Для большинства бактерий и плазмид обычна суперспирализированная форма. У микроорганизмов ряда видов встречаются плазмиды в линейной форме, например, у стрептомицетов – плазмида SCP1. Значительная часть сверхспиральной ДНК отдельных плазмид находится в «релаксационном» комплексе с белком. Кольцевая форма молекулы ДНК плазмиды характерна лишь для бактерий, но не для грибов и растений, где она существует в линейной форме.
1.2.3.2 Механизм репликации Существует три основных механизма репликации кольцевых плазмид: тета- (Θ)-репликация, репликация с вытеснением цепи и репликация по типу «катящегося кольца». 1. Тета-(Θ)-репликация(Рисунок 1.2). При этом типе происходит: 1.Расщепление водородных связей между цепями и расплетение двойной спи- рали ДНК, то есть катализируется белками Repи DnaAи/или в ходе начала транскрипции плазмиды РНК-полимеразой; 2.Синтез праймерной РНК (пРНК); 3.Инициация синтеза ДНК на праймере, путём его ковалентной модификации — присоединения комплементарных нуклеотидов к 3’-концу.
Тета-репликация может начинаться в одной или нескольких точках oriи быть одно- и двунаправленной. Своё название этот механизм получил благодаря сходству молекулы плазмиды, реплицирующейся по данному механизму, с греческой буквой тета (Θ). Репликация ДНК происходит непрерывно на лидирующей цепи и прерывисто на отстающей (запаздывающей) цепи. В итоге этого метода получаются две кольцевые двухцепочечныеплазмиды. 2. Репликация с вытеснением цепи(Рисунок 1.3). При этом методе происходит расплетение двойной спирали хеликазами, а затем синтез новой цепи (или цепей) с вытеснением родительской.
Рисунок 1.3 - Репликация с вытеснением цепи:(A)однонаправленная; (B)двунаправленная. Этапы репликации: 1.Репликация начинается с присоединения белка RepCк итеронам точки oriплазмиды. ХеликазаRepAсвязывается с обеими цепями в области АТ-повторов (недалеко от сайта связывания RepC) и расплетает двойную спираль ДНК, открывая и активируя ssi-сайты. Однако плавление дуплекса ДНК может быть вызвано и взаимодействием белка RepC с итеронами вблизи ssi-сайтов. 2.ssiAи ssiBявляются участками, на которых непосредственно синтезируются праймеры и начинается репликация. 3.Именно с ssiAи ssiBсвязывается RepB(праймаза). Инициация репликации на любом из ssi-сайтов плазмидной ДНК может происходить независимо. При этом RepAхеликаза во время синтеза вытесняет нереплицируемую цепь ДНК (в виде D-петли). Продукты репликации «с вытеснением цепи»: — двухцепочечныесверхспирализованные кольцевые ДНК (дцДНК); — вытесненные одноцепочечные кольцевые ДНК (оцДНК, в случае однонаправленного синтеза); — частично двухцепочечные кольцевые ДНК (в случае двунаправленного синтеза). 3. Репликация по механизму «катящегося кольца»(Рисунок 1.4). Особенность этого механизма в том, что в самом начале процесса одна из родительских цепей разрывается (разрыв фосфодиэфирной связи). В результате образуются свободные 3’- и 5’-концы. К свободному 3’-концу ДНК-полимераза начинает присоединять нуклеотиды по принципу комплементарности. Этапы репликации: 1.Репликация по данному механизму начинается с того, что закодированный в плазмиде Rep-белок разрывает фосфодиэфирную связь на положительной цепи ДНК. Эта область получила название «двухцепочечной точки ori» (или двухцепочечныйориджин — dso). 2.При разрыве образуется свободный 3′-OH конец, который используется как праймер при синтезе лидирующей цепи (при участии ДНК-полимеразы III, SSB-белкови хеликазы). 3.Элонгация с вытеснением родительской положительной цепи продолжается до тех пор, пока реплисома не достигнет сайта dso, на котором синтез лидирующей цепи завершается с замыканием новой цепи и отщеплением родительской положительной цепи, послужившей праймером при синтезе.
Рисунок 1.4 - Репликация по механизму «катящегося кольца» Продукты репликации по механизму «катящегося кольца»: 1.Двухцепочечная ДНК (дцДНК), состоящая из родительской отрицательной и синтезированной положительной цепей; 2.Одноцепочечная ДНК (оцДНК), представляющая собой родительскую положительную цепь.
3. Маркерных генах, содержащихся на плазмидах круге хозяев В зависимости от свойств признаков, которые кодируют плазмиды, различают: 1) R-плазмиды. Обеспечивают лекарственную устойчивость; могут содержать гены, ответственные за синтез ферментов, разрушающих лекарственные вещества, могут менять проницаемость мембран; 2) F-плазмиды. Кодируют пол у бактерий. Мужские клетки (F+) содержат F-плазмиду, женские (F—) – не содержат. Мужские клетки выступают в роли донора генетического материала при конъюгации, а женские – реципиента. Они отличаются поверхностным электрическим зарядом и поэтому притягиваются. От донора переходит сама F-плазмида, если она находится в автономном состоянии в клетке. F-плазмиды способны интегрировать в хромосому клетки и выходить из интегрированного состояния в автономное. При этом захватываются хромосомные гены, которые клетка может отдавать при конъюгации; 3) Col-плазмиды. Кодируют синтез бактериоцинов. Это бактерицидные вещества, действующие на близкородственные бактерии; 4) Tox-плазмиды. Кодируют выработку экзотоксинов; 5) плазмиды биодеградации. Кодируют ферменты, с помощью которых бактерии могут утилизировать ксенобиотики. Потеря клеткой плазмиды не приводит к ее гибели. В одной и той же клетке могут находиться разные плазмиды.
1.3 Метод выделения плазмид Для выделения плазмид разработано несколько методов. Они различаются по чистоте конечного продукта, скорости выделения и возможности их использования для выделения плазмид из большого («maxiprep») и промежуточного («midiprep») объемов бактериальной культуры или для одновременного выделения плазмидной ДНК из большого числа культур малого объема («miniprep»).
Для выделения плазмидной ДНК пользуются многими методами. Все они включают три основных этапа: 1. Рост бактерий и амплификацию плазмиды; 2. Сбор бактерий и их лизис; 3. Очистку плазмидной ДНК. Амплификацию плазмид производят при выращивании бактерии-хозяина в богатой среде в присутствии хлорамфеникола. Ночную культуру (10 мл LB c добавлением антибиотика) пересевают в свежую среду LB (0.2 мл н.к. в 25 мл LB c антибиотиком) и инкубируют пока культура не достигнет поздней логарифмической фазы (D600=0,6). Переносят культуру в свежую среду LB с антибиотиком (500 мл), инкубируют 2,5 часа (при этом титр удваивается), добавляют антибиотик до концентрации 170 мкг/мл и инкубируют еще 12-16 ч. Метод щелочного лизиса клеток бактерий, разработанного Бирнбоймом и Доли в 1979 году (Birnboim, Doly, 1979). Этот способ позволяет легко отделить плазмидную ДНК от высокомолекулярной хромосомной ДНК. Для последующего выделения биологически активной ДНК можно добиться разными способами.Бактериальные клетки собирают центрифугированием и лизируют с помощью ЭДТА, разрушающего клеточную стенку. Метод щелочного лизиса основан на том, что в щелочных условиях при рН ~ 12 происходит денатурация только линейных молекул ДНК (двухцепочечной геномной ДНК клетки-хозяина), плазмидные же ССС-молекулы не денатурируют. При нейтрализации клеточного экстракта в присутствии солей высокой концентрации денатурированная хромосомная ДНК выпадает в осадок, поскольку реассоциация длинных линейных одноцепочечных молекул ДНК происходит в этих условиях одновременно во множестве участков с образованием нерастворимых комплексов. Часть клеточной РНК и белков тоже осаждаются вследствие того, что при осаждении используется детергент додецил-сульфат натрия. Дополнительно для удаления РНК используют РНК-азу, а для расщепления белков используют щелочную протеазу. После удаления осадка геномной ДНК, РНК и белков путем центрифугирования, проводят дальнейшую очистку плазмидной ДНК.
1.4 Количественное определение ДНК с помощью спектрофотометрии. Количественное содержание ДНК, РНК, олигонуклеотидов и даже мононуклеотидов может быть определено непосредственно в водном растворе в разведенном, или не разведенном виде путем измерения величины поглощения А (также определяемой, как оптическая плотность, OD) в ультрафиолетовом свете (а также и в видимой части спектра). Если определяемый образец достаточно очищен (то есть, без значительного количества примесей, таких как белки, фенол или агароза), спектрофотометрическое определение количества ультрафиолетового света, поглощаемого основаниями, является простым и точным. Для этого метода идеальным является буфер с низкой ионной концентрацией (например, ТЕ буфер). Концентрация нуклеиновых кислот обычно определяется при длине волны 260 нм, в сравнении со стандартным раствором. Влияние примесей на результат может быть выявлено по вычислению «отношения» на чистоту полученного образца. Так как белки поглощают при длине волны 280 нм, отношение А260/А280 может свидетельствовать о степени чистоты препарата.
1.5 Методагарозного электрофореза ДНК. Электрофорез ДНК - один из основных инструментов в молекулярной биологии. Метод используется для: --разделения молекул ДНК и РНК по их размеру и определение размера по Маркеру; - определения примерного количества ДНК по яркости свечения; - вырезания нужной ДНК из геля и использовать в дальнейшем; - анализа результатов проведения ПЦР, а также для других целей;
Разделение фрагментов ДНК происходит из-за наличия у них заряда. Фосфатные остатки у нуклеотидов придают всей ДНК негативный заряд. Это делает ее растворимой в воде и заставляет двигаться под действием тока к положительному электроду. Чтобы ДНК двигалась медленнее, ее помещают в вязкую среду, в агарозный гель. Увеличение концентрации агарозы в геле уменьшает скорость миграции ДНК и позволяет разделять малые ее фрагменты.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ МАТЕРИАЛЫ И МЕТОДЫ Оборудование Таблица 1 - Оборудование
Использованные микроорганизмы и плазмиды В работе были использованы клетки E.coli штаммов BL21(plys) pET28a (плазмида устойчивая к канамицину) с молекулярной массой около 5,3 кб и BL21(plys) pGS21a (плазмида устойчивая к ампициллину) с молекулярной массой окло 6,1 кб. |
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 284. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||
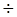 350 МД и более (1000
350 МД и более (1000 
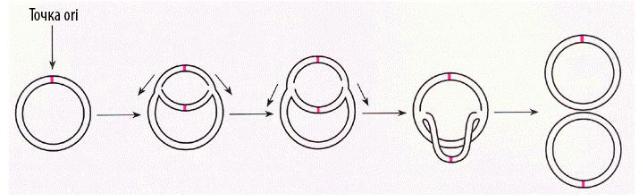 Рис. 1.2 - Тета-репликация:общая схема.
Рис. 1.2 - Тета-репликация:общая схема.