Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Деградационная фаза апоптоза
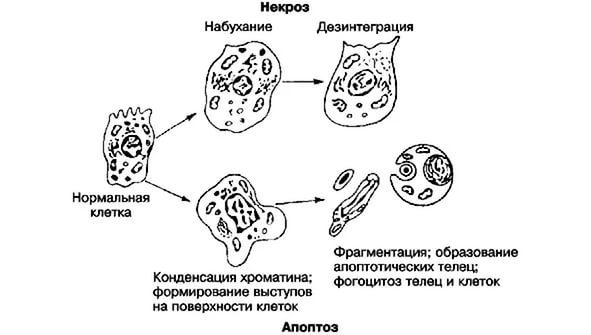
Итогом программируемой клеточной гибели является деградация клетки путём фрагментации на отдельные апоптотические тельца, ограниченные плазматической мембраной. Фрагменты погибшей клетки обычно очень быстро (в среднем за 90 минут) фагоцитируются макрофагами либо соседними клетками, минуя развитие воспалительной реакции. 1. Первая стадия – преапоптоз. На этой стадии происходит уменьшение размеров клетки за счет ее сморщивания, возникают обратимые изменения в ядре (уплотнение хроматина и скопление его по периферии ядра). В случае воздействия некоторых специфических регуляторов апоптоз может быть остановлен, и клетка возобновит свою нормальную жизнедеятельность. 2. Вторая стадия – собственно апоптоз. 1. Сжатие клетки. Клетка уменьшается в размерах; цитоплазма уплотняется; органеллы, которые выглядят относительно нормальными, располагаются более компактно. Нарушение формы и объема клетки происходит в результате активации в апоптотических клетках трансглютаминазы. Этот фермент вызывает прогрессивное образование связей в цитоплазматических белках, что приводит к формированию своеобразной оболочки под клеточной мембраной, подобно ороговевающим клеткам эпителия. 2. Конденсация хроматина. Хроматин конденсируется по периферии, под мембраной ядра, при этом образуются четко очерченные плотные массы различной формы и размеров. Ядро же может разрываться на два или несколько фрагментов.Механизм конденсации хроматина обусловлен расщеплением ядерной ДНК в местах, связывающих отдельные нуклеосомы, что приводит к развитию большого количества фрагментов.  3. Формирование в цитоплазме полостей и апоптотических телец. В апоптотической клетке первоначально формируются глубокие впячивания поверхности с образованием полостей, что приводит к фрагментации клетки и формированию окруженных мембраной апоптотических телец, состоящих из цитоплазмы и плотно расположенных органелл, с или без фрагментов ядра.Фагоцитоз апоптотических клеток или телец осуществляется окружающими здоровыми клетками, или паренхиматозными, или макрофагами. Апоптотические тельца быстро разрушаются в лизосомах, а окружающие клетки либо мигрируют, либо делятся, чтобы заполнить освободившееся после гибели клетки пространство.Фагоцитоз апоптотических телец макрофагами или другими клетками активируется рецепторами на этих клетках: они захватывают и поглощают апоптотические клетки.
МЕТОДЫ ИССЛЕДОВАНИЯ АПОПТОЗА Апоптоз– это программируемая, генетически опосредованная форма клеточной гибели, при которой внешние или внутренние сигналы дают импульс клетке к образованию или активации ферментов, приводящих ее к самоуничтожению. Сигналы к апоптозу (Лиганды) 1. FAS-лиганд (sFASL) 2. TRAIL трансмембранный белок 3. CD30 (Ki-1) 4. CD40L 5. Цитокин TWEAK Рецепторы к сигналам апоптоза: 1. Растворимый FAS (sFas) FAS, также называемый CD95 или APO-1 2. DR5 (Death Receptor) «Рецепторысмерти» Регуляторы апоптоза: Bcl-2 Белок р53 Семейство каспаз Белки теплового шока (HSP)
1. Характеристика сигналов к апоптозу лимфоцитов (Лиганды): 1. FAS-лиганд (sFASL) FAS-лиганд, известный как «фактор смерти», связывается с FAS-рецептором и индуцирует гибель клеток: уничтожение зрелых Т-клеток на завершающих стадиях иммунного ответа, киллинг опухолевых или инфицированных вирусом клеток цитотоксическими T-лимфоцитами и NK-клетками. Потеря функциональной активности Fas-системы вызывает гиперплазию и лимфопролиферацию У пациентов накапливаются лимфоциты, несущие гетерозиготные мутации в гене Fas, не являющиеся канцерогенными. Отклонение от нормы в выживании лимфоцитов может позволить клеткам накапливать мутации, приводящие к злокачественности. 2. TRAIL трансмембранный белок. TNFSF10, или TRAIL (от англ. Tumornecrosisfactorligandsuperfamilymember 10; TNF-relatedapoptosis-inducingligand) — цитокин семейства факторов некроза опухоли, лиганд, вызывающийапоптоз. В результате расщепления протеазами внеклеточный домен TRAIL высвобождается из клетки. Рекомбинантный растворимый TRAIL способен вызывать апоптоз в клетках из широкого спектра человеческих опухолей, не затрагивая нормальные клетки. 3. CD30 (Ki-1) - трансмембранный белок. Взаимодействие цитокинового рецептора CD30 со своим лигандом обладает биологическими эффектами, такими как: дифференцировка, активация, пролиферация и клеточная гибель. CD30 передает информа-цию, необходимую для иммунного ответа. 4. CD40L - ко-стимулятор пролиферации Т-клеток, экспрессируется активированными Т-клетками. Взаимодействие CD40-CD40L играет центральную роль на различных фазах В-клеточного ответа на Т-зависимые антигены. 5. Цитокин TWEAK является трансмембранным белком. Осуществляет передачу сигнала с использованием нескольких различных TNFR-ассоциированных факторов. Осуществляет стимуляцию роста клеток и ангиогенез, индукцию воспалительных цитокинов, а при некоторых экспериментальных условиях стимулирует апоптоз. Характеристика рецепторов к сигналам апоптоза 1. Растворимый FAS (sFas) FAS, также называемый CD95 или APO-1, относится к классу рецепторов TNF/NGF Fas-опосредованный путь апоптоза. Инициаторная фаза апоптоза может осуществляться опосредовано через «рецепторы смерти». Для его развития необходимо взаимодействие Fas-рецептора, презентированного на мембране Fas-позитивных клеток, и Fas-лиганда. 2. DR95 (DeathReceptor) «Рецепторы смерти» (DR) СD95-рецепторно-лигандная система принимает непосредственное участие в апоптозе, индуцированном через CD3 Т-клеточный рецептор антигена. CD95-лиганд вовлечен в цитотоксическое действие Т-лимфоцитов. Цитотоксические Т-лимфоциты убивают клетки-мишени поляризуя гранулы, содержащие перфорины или гранзимы, вызывающие клеточную смерть через повреждение мембраны или ДНК.
|
||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 406. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |