Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
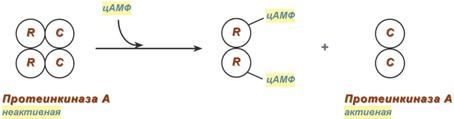
Протеолитическая модификация активности ферментов. Ограниченный протеолиз как способ регуляции ферментативной активности на примере протеинкиназы А.Регуляция активности ферментов путем химической модификации - это наиболее часто встречаемый механизм регуляции активности ферментов путем ковалентной модификации аминокислотных остатков. При этом модификации подвергаются ОН-группы фермента. Фосфорилирование осуществляется ферментами протеинкиназами за счет АТФ. Присоединение остатка фосфорной кислоты приводит к изменению каталитической активности, при этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие – становятся менее активными. Изменение активности путем фосфорилирования обратимо. Отщепление остатка фосфорной кислоты осуществляется протенфосфатазами. Существует также регуляция активности ферментов путем ограниченного протеолиза. Некоторые ферменты синтезируются в виде неактивных предшественников – проферментов и активируются в результате гидролиза одной или нескольких определенных пептидных связей, что приводит к отщеплению части белковой молекулы профермента. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр и фермент становится активным. Отщепление пептида от белков-предшественников катализируют ферменты пептидазы. При этом активность фермента изменяется необратимо. Ограниченный протеолиз лежит в основе активации протеолитических ферментов ЖКТ, белков свертывающей системы крови и системы фибринолиза, а также белково-пептидных гормонов. Например, трипсиноген, синтезируемый в поджелудочной железе, поступает в кишечник, где на него действует фермент энтеропептидаза. В результате происходит ограниченный протеолиз с отщеплением гексапептида. При этом в оставшейся части молекулы формируется активный центр и образуется активный трипсин. Примером белок-белкового взаимодействия может быть регуляция активности протеинкиназы А. Протеинкиназа А является тетрамерным ферментом, состоящим из 2 каталитических (С) и 2 регуляторных (R) субъединиц. Активатором для протеинкиназы А является цАМФ (циклический аденозинмонофосфат). Присоединение цАМФ к регуляторным субъединицам фермента вызывает их отхождение от каталитических субъединиц. Каталитические субъединицы при этом активируются.
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 1248. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |