Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
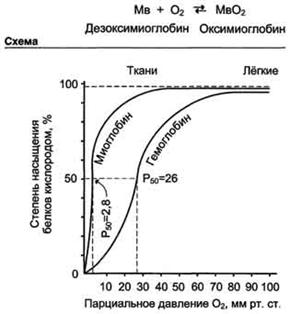
Вопрос № 10 Четвертичная структура белка (ЧСБ)ЧСБ-способ укладки в пространстве отдельных полипептиных цепей(протомеров, субъединиц),обладающих одинаковой( или разной) 1-й,2-1 или 3-й стр-турой, и формирование единого в струк-ном и функ-ном отношениях макромолекулярного образования. Каждая цепь имеет 3 уровня организации . Белок, содержащий в своём составе несколько протомеров, называют олигомерным. В состав олигомерных белков может входить от 2 до нескольких десятков протомеров. Олигомерные белки имеют большую молекулярную массу. Протомеры связаны друг с другом посредством лишь нековалентных связей (ионных, водородных, гидрофобных). По сравнению с мономерными белками олигомеры выполняют более сложные функции. Узнавание и присоединение отдельных протомеров олигомерного белка происходят благодаря формированию на их поверхности контактных участков, кот. состоят из радикалов АК, собранных в данном месте в процессе образования третичной структуры белка. Совокупность этих радикалов формирует поверхности, объединяться друг с другом. Когда субстрат связывается с активным центром одной субъединицы фермента, остальные субъединицы активируются. Лиганды могут иметь некооперативный, положительный или отрицательный кооперативный эффект. Молекула миоглобина может присоединять только 1 молекулу кислорода в свой активный центр, в то время как молекула гемоглобина состоит из 4 протомеров и имеет 4 центра связывания Кооперативность— это такие изменения состояния системы, взаимодействие элементов которой усиливается с течением процесса изменения так, что существенно ускоряет его ход в целом (положительная кооперативность).  Отрицательная кооперативность означает противоположное — в момент связывания лиганда белком, сродство белка к лиганду снижается.
Вопрос № 11 Изменение функциональной, активности белка при взаимодействии с Другими лигандами вследствие конформационных изменений называется аллостерической регуляцией, а соединения-регуляторы — аллостерическими лигандами. Способность к аллостерической регуляции характерна, как правило, для олигомерных белковд т.е. для проявления аллостерического Эффекта необходимо взаимодействие протомеров. При воздействии аллостерических лигандов белки меняют свою конформацию (в том числе и активного центра) и функцию. Молекула гемоглобина способна связываться с несколькими лигандами: 02, Н’", СО2. 2,3—бисфосфоглицератом (БФГ). Н+‚ СО2 и БФГ являются аллостерическими регуляторами активности гемоглобина и присоединяются к участкам (аллостерическим центрам), пространственно удаленным от активного центра. Концентрация аллостерических лигандов снижает сродство гемоглобина к кислороду, а миоглобин и отдельные субъединицы гемоглобина нечувствительны к изменениям концентрации Н+‚ СО2 и БФГ, т.е. аллостерические свойства гемоглобина возникают только в результате взаимодействия субьединиц. Эффект Бора Hb не только переносит кислород от легких к периферическим тканям, но и ускоряет транспорт углекислого газа от тканей к легким. Гемоглобин связывает углекислый газ сразу после высвобождения кислорода. Находящаяся в эритроцитах карбоангидраза катализирует превращение поступающего из тканей углекислого газа в угольную кислоту. Угольная кислота быстро диссоциирует на бикарбонат-ион и протон, причем равновесие вдвинуто в сторону диссоциации. Для предотвращения опасного повышения кислотности крови должна существовать буферная система, способная поглощать избыток протонов. Гемоглобин связывает два протона на каждые четыре освободившиеся молекулы кислорода и определяет буферную емкость крови. В легких идет обратный процесс: присоединение кислорода к дезоксигемоглобину сопровождается высвобождением протонов, которые связываются с бикарбонат-ионами, переводя их в угольную кислоту. Далее эффективно действующая карбоангидраза катализирует превращение угольной кислоты в углекислый газ, выдыхаемый из легких. Таким образом, связывание кислорода тесно сопряжено с выдыханием углекислого газа. Это обратимое явление известно как эффект Бора.
Вопрос № 12 Ферменты-это белки имеющие специфическую первичную ,вторичную , третичную ,а иногда и четвертичную структуру.Они могут быть простыми и сложными белками. Если фермент –сложный белок ,то его небелковую часть называют кофакторомили коферментом ,а белковую апоферментом.Апофермент с коферментом образуют активную форму катализатора – холофермент.
Вопрос № 13 Понятия: холофермент, апофермент, кофактор, субстрат, продукт реакции, ингибитор, активатор. Примеры. Ферменты-это белки, имеющие специфическую первичную, вторичную, третичную, а иногда четвертичную структуру. Они могут быть простыми или сложными белками. Если фермент-сложный белок, то его небелковую часть называют кофактором, или коферментом(ионы металлов, а белковую-апоферментом. Апофермент с кофактором образует активную группу катализатора-холофермент: Апофермент+Кофактор-Холофермент.
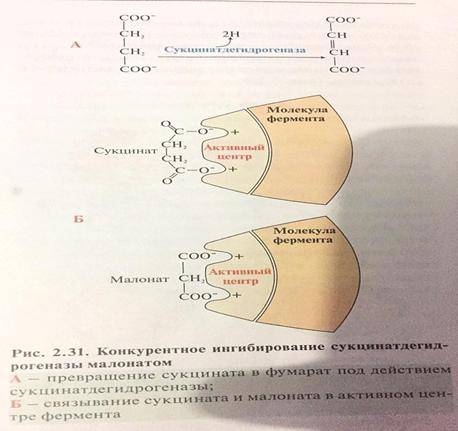
Субстрат-исходное вещество, преобразуемое ферментом в результате специфического фермент-субстратного взаимодействия в один или несколько конечных продуктов. Продукт реакции-это те вещества, которые получаются в результате реакции. Ингибиторы-природные вещества, полностью подавляющие или снижающие активность фермента. Они взаимодействуют с ферментом в области активного центра или в другом месте, изменят конформацию фермента, активного центра и снижают его активность. Различают: обратимые и необратимые ингибаторы. Обратимые-связываются с ферментом посредством образования слабых нековалентных связей. Обратимые ингибиторы бывают 2 типов: конкурентные и неконкурентные. Обратимые конкурентные ингибиторы-они связываются в активном центре фермента, но не могут превращаться в продукт. Например:малоновая кислота(малонат) очень близка по структуре к янтарной кислоте(сукцинату), конкурирует с последней за активный центр фермента сукцинатдегидрогеназы, катализирующего превращение сукцината в фумарат.
Субстрат и ингибитор(малонат) взаимодействуют с одними и теми же положительно заряженными группами каталитического центра фермента,т.к. обе кислоты при физиологических значениях pH имеют 2 отрицательно заряженные карбоксильные группы. Малоновая кислота может быть вытеснена из активного центра фермента большими концентрациями сукцината. Неконкурентные ингибиторы присоединяются к ферменту не в активном центре, а в другом месте, вызывая изменение конформации фермента и активного центра. Следовательно, обратимое неконкурентное ингибирование фермента не может быть устранено повышением концентрации субстрата. Необратимые специфические ингибиторы ковалентно связываются или разрушают функциональнозначимую группу молекулы АЦФ, необходимую для проявления его каталитической активности. (Действие производных фторфосфатов) Диизопропилфторфосфат ДФФ образ ков. Связь с ОН-группой серина в АЦФ АХестеразы, сериновой гидралазой,,катализируюая: АХ→ацетат+холин. При связыв с ингибитором АХестеразы не гидрролизует АХ. Фторфосфаты бывают: нервнопаралитические яды и инсектициды(передоз-паралич). Необратимые неспецифические ингибиторы H2S,соли cвинца, серебра и ртути. Они связываются с Белковой молекулой фермента вне АЦФ и образ плохо растворимые комплексы. Изменяется конформации мол фермента и АЦФ. Активатор-повышают скорость реакции. Активирующее влияние на скорость реакции оказывают разнообразные вещества органической и не органической природы. Напр:Соляная к-та активирует действие пепсина желудочного сока. Часто активаторами выступают ионы двухвалентных и ,реже, одновалентных металлов. |
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 378. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
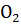 . Олигомерный белок гемоглобин, в отличие от мономерного миоглобина, способен присоединять к специфическим участкам 4 различных лиганда:
. Олигомерный белок гемоглобин, в отличие от мономерного миоглобина, способен присоединять к специфическим участкам 4 различных лиганда: 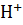 ,
, 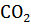 и 2,3-бисфосфоглицератом (БФГ).
и 2,3-бисфосфоглицератом (БФГ).