Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
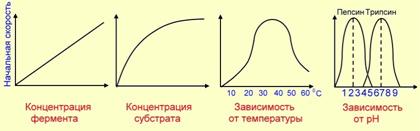
Вопрос № 14 Химическая структура ферментов. Активный центр ферментов, состав, формирование, роль. Функциональные группы аминокислот, входящих в активный центр.Ферменты – это белки, имеющие специфическую первичную, вторичную, третичную, а иногда и четвертичную структуру. Ферменты могут быть как простыми, так и сложными белками. Если фермент относится к сложным белкам, то его белковая часть называется апоферментом, а небелковая (простетическая группа) - коферментом. Существуют и ферменты, в состав которых входит несколько апоферментов и коферментов. Активность ферментов, способность ускорять реакции зависит от степени сохранности нативной структуры белка. При нарушении нативной конформации, например, при нагревании, резком изменении pH, воздействии денатурирующих агентов. Они теряют каталитические свойства. Большинство ферментов проявляет активность в водных растворах при физиологических значениях pH и температуры. Ферменты не влияют на положение равновесия ускоряемых ими реакций, в ходе реакции они не расходуются и не претерпевают необратимых изменений. Участок молекулы фермента, который предназначен для специфического связывания субстрата, называется активным центром. Активный центр – это уникальная комбинация аминокислотных остатков в молекуле фермента, обеспечивающая непосредственное его взаимодействие с молекулой субстрата и принимающая прямое участие в акте катализа. У сложных ферментов в состав активного центра входит также кофактор. В активном центре условно различают каталитический участок, непосредственно вступающий в химическое взаимодействие с субстратом и участок связывания, который обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом. На активный центр приходится относительно малая часть объёма фермента (5-10 аминокислотных остатков). Роль остальных аминокислот, составляющих основную массу фермента, состоит в том, чтобы обеспечить молекуле фермента правильную конформацию для оптимального протекания химической реакции. Активный центр – это сложная трёхмерная структура, в образовании которой принимают участие группы, принадлежащие разным частям линейной последовательности аминокислот. Радикалы аминокислот, образующих активный центр, оказываются вблизи друг от друга в результате формирования третичной структуры белка. Поэтому при воздействии физических и химических факторов, вызывающих денатурацию (нагревание, концентрированные кислоты и щёлочи) утрачивается конформация активного центра и фермент теряет свою активность. Он имеет форму узкого углубления или щели, в которую ограничен доступ воде, за исключением тех случаев, когда вода является одним из реагирующих веществ. В этом углублении присутствует несколько полярных аминокислотных остатков, необходимых для связывания субстрата и катализа. В составе активного центра можно условно выделить две части: контактный или якорный участок, где происходит связывание субстрата в нужной ориентации, и каталитический участок, обеспечивающий протекание реакции. Четкую грань между каталитическим и субстратным центром провести можно не всегда – у некоторых ферментов они совпадают или перекрываются.  Механизмы ферментативного катализа определяются ролью функциональных групп активного центра фермента в химической реакции превращения субстрата в продукт. Выделяют 2 основных механизма ферментативного катализа: кислотно-основной катализ и ковалентный катализ. Кислотно-основной катализ – часто встречающееся явление. Аминокислотные остатки, входящие в состав активного центра, имеют функциональные группы, проявляющие свойства как кислот, так и оснований. К аминокислотам, участвующим в кислотно-основном катализе, в первую очередь относят Цис, Тир, Сер, Лиз, Глу, Асп и Гис. Радикалы этих аминокислот в протонированной форме – кислоты (доноры протона), в депротонированной – основания (акцепторы протона). Благодаря этому свойству функциональных групп активного центра ферменты становятся уникальными биологическими катализаторами, в отличие от небиологических катализаторов, способных проявлять либо кислотные, либо основные свойства. Ковалентный катализ основан на атаке нуклеофильных (отрицательно заряженных) или электрофильных (положительно заряженных) групп активного центра фермента молекулами субстрата с формированием ковалентной связи между субстратом и коферментом или функциональной группой аминокислотного остатка (как правило, одной) активного центра фермента. Действие сериновых протеаз, таких как трипсин, химотрипсин и тромбин, - пример механизма ковалентного катализа, когда ковалентная связь образуется между субстратом и аминокислотным остатком серина активного центра фермента. Термин «сериновые протеазы» связан с тем, что аминокислотный остаток серина входит в состав активного центра всех этих ферментов и участвует непосредственно в катализе. Субстратами химотрипсина служат пептиды, содержащие аминокислоты с ароматическими и циклическими гидрофобными радикалами (Фен, Тир, Три), что указывает на участие гидрофобных сил в формировании фермент-субстратного комплекса. Вопрос №15 . Активный центр Активный центр -это участок на молекуле белка, в котором происходят взаимодействия фермента с субстратом. Субстрат - исходное вещество, преобразуемое ферментом в результате специфического фермент-субстратного взаимодействия в один или несколько конечных продуктов. Комплементаарность - взаимное соответствие молекул биополимеров или их фрагментов, обеспечивающее образование связей между пространственно взаимодополняющими (комплементарными) фрагментами молекул или их структурных фрагментов вследствие супрамолекулярных взаимодействий. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и "подгоняется" под лиганд. Между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи(ковалентные или нековалентные), удерживающие лиганд в активном центре Активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная структура. "Гипотеза индуцированного соответствия"Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции. Вопрос № 16 При оптимальных условиях активность фермента зависит от Уравнение · {\displaystyle V_{m}}V — максимальная скорость реакции, равная {\displaystyle k_{cat}E_{0}}; · {\displaystyle K_{M}}Km — константа Михаэлиса. Графики зависимости от конц. фермента ,субстрата, температуры и Ph. Вопрос № 17 Ингибирование ферментативной активности - снижение каталитической активности в присутствии определённых веществ - ингибиторов. К ингибиторам следует относить вещества, вызывающие снижение активности фермента. Обратимые ингибиторы связываются с ферментом посредством образования слабых нековалентных связей. Фермент восстанавливает свою нативную конформацию и активность после диссоциации ингибитора. Обратимые ингибиторы бывают конкурентными и неконкурентными. К конкурентному ингибированию Являются структурными аналогами субстратов. Онисвязываются в активном центре фермента но не могут превращатся в продукт. Обратимые конкуретные ингибиторы конкурируют с субстратом за актвный центр фермента. При повышении концентрации субстрата он вытесняет ингибитор за активного центра фермента. Напрмер малоновая кислота малонат очень близкая по структуре к янтарной кислоте сукцинату конкурирует с последней за активный центр фермента сукцинатдегидрогеназы катализирующего превращение сукцината в фумрат. Субстрат и ингибитор малонат взаимодействуют с одним и тем же положительно заряженными группами каталитического центра фермента так как обе кислоты при физиологических значениях рН имеют две отриц. заряженные карбоксильные группы. Неконкурентным присоединяются к ферменту не в активном центре а в другом месте вызывая изменения конформации фермента и его активного центра. Следовательно, обратимое неконкурентное ингибирование фермента не может быть устроено повышением концентрации. Неконкурентный ингибитор может связывается обратимо как со свободным ферментом так и с фермент-субстратным комплексом. При снижение концентрации ингибитора он диссоциирует из комплексов EI, ESI и происходит постепенное восстановление ферментативной активности Необратимое ингибирование специфические ковалентно связываются или разрушают функциональнозначимую группу молекул активного центра фермента, необходимую для проявления его каталитической активности. Присером такого ингибирования может быть действие производных фторофосфотов. Дизопропилфторофосфат образует прочную ковалетную связь с ОН-группой серина в активном центре фермента ацетилхолинстеразы. Она является сериновой гидролазой и катализирует расщепление ацетилхолина до ацетата и холина. При связывании с ингибитором ацетилхолинстераза не гидролизирует ацетилхолин, блокируется процесс деполяризации мембраны и проведение нервного импульса. К группе фторфосфатов относятся нервнопаралитические яды и инсектициды. При поступлении больших количеств этих веществ в организм может наступить паралич. Кроме того, ДФФ может необратимо ингибировать сериновые протеазы – пищеварительные ферменты трипсин, химотрипсин, эластазу, а также присутствующие в слюне катепсины B,H,L. Необратимое ингибирование неспецифическиеявляются сероводород, соли свинца, серебра и ртути. Эти вещества связываются с белковой молекулой фермента вне активного центра и образуют плохо растворимые комплексы. При это необратимо изменяются конформация всей молекулы фермента и как следствие конформацтя активного центра. |
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 1365. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
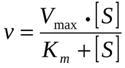 где
где