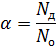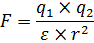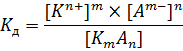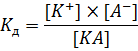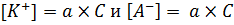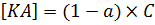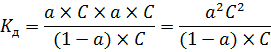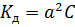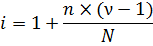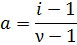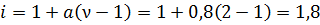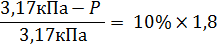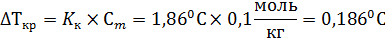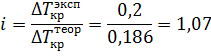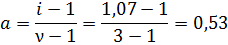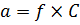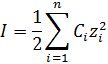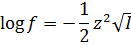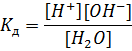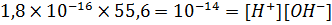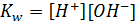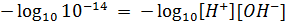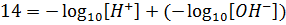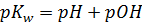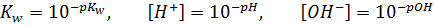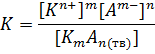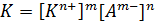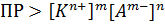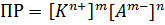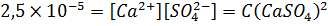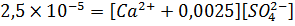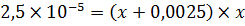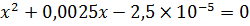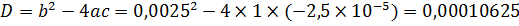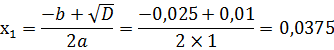Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Ионы представляются как точечные заряды, взаимодействия между которыми отсутствуют (подобны идеальным газовым смесям). ⇐ ПредыдущаяСтр 4 из 4 6) Диссоциация – процесс обратимый, поскольку одновременно протекают процесс распада молекул на ионы (диссоциация) и процесс соединения ионов в молекулы (ассоциация). В общем случае, согласно этой теории, уравнение диссоциации молекулы электролита КmАn на катион Кn+ и анион Аm- записывается так: КmАn D mКn+ + nАm- В левой части уравнения молекула одна, а в правой m моль катионов и n моль анионов. Отсюда действительно видно, что количество частиц в растворе в результате диссоциации электролита увеличивается (был 1 моль частиц, а стало m+n), поэтому наблюдаются отклонения от законов Рауля и Вант-Гоффа. Становится понятен физический смысл изотонического коэффициента – он состоит в увеличении общего числа частиц в растворе за счет диссоциации растворенного вещества на ионы. Кроме того, катионы и анионы являются заряженными частицами, что позволяет растворам электролитов проводить электрический ток. Именно с позиций этой теории стало возможно дать четкое определение терминам «кислота» и «основание», которое до сих пор используется в школе. Неудивительно, что за создание этой теории Аррениус получил Нобелевскую премию в 1903 году. Из этих положений видно, что Аррениус был сторонником физической теории растворов, в которой рассматривался идеальный раствор. В ней отсутствует описание химического взаимодействия между электролитом и растворителем, а именно оно определяет ряд важных моментов: · почему в одном растворителе вещество диссоциирует хорошо, а в другом плохо; · почему в результате растворения образуется сольватная оболочка; · почему в концентрированных растворах и растворах сильных электролитов расчетное значение i не соответствует действительности и т.д.  За что эта теория и критиковалась сторонниками химической теории растворения, в частности Менделеевым. В конечно итоге, благодаря трудам И.А. Каблукова и В.А. Кистяковского была доказана химическая природа процесса растворения, что привело к объединению физической и химической теории. Согласно современным представлениям, в процессе растворения происходят процессы молекулярной диссоциации, образования сольватной оболочки, поляризации и электролитической диссоциации, причем их последовательность для различных веществ неодинакова. Если химическая связь является ковалентной полярной (например, в молекуле H-Cl), то сначала происходит сольватация молекулы, затем поляризация (смещение общей электронной пары к электроотрицательному атому) и гетеролитический разрыв ковалентной связи, а затем завершается процесс сольватации полученных ионов. Эту последовательность в общем случае можно описать двумя химическими уравнениями: 1) KA+(x+y)SolDKA·(x+y)Sol – образование сольватной оболочки вокруг молекулы. Sol – сокращение от solvent – растворитель. 2) KA·(x+y)Sol D К+·xSol +А-·ySol – поляризация свизи между катионами и анионами внутри сольватированной молекулы и её гетеролитический разрыв с последующим образованием сольватной оболочки вокруг каждого иона. Если в этих уравнениях заменить формулу растворителя формулой воды, то ими будет описан частный случай сольватации – гидратация: KA+(x+y) H2O DKA·(x+y) H2O KA·(x+y)H2O D К+·x H2O +А-·yH2O Эти процессы можно проиллюстрировать рисунком 6.3. Молекулы воды являются диполями (один конец молекулы заряжен положительно, другой отрицательно), поэтому при образовании гидратной оболочки молекулы воды выстраиваются определенным образом вокруг молекулы растворяемого вещества:
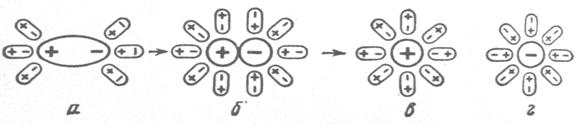
Рисунок 6.3. Электролитическая диссоциация вещества с ковалентной полярной связью. На стадии a образуется гидратная оболочка вокруг молекулы растворенного вещества. На стадии б происходит поляризация и гетеролитический разрыв связи. Состояния в и г соответствуют гидратированным катиону и аниону. Если химическая связь является ионной (например, в кристалле NaCl), то её поляризация не требуется. Вспомним кристаллическую структуру веществ с ионной связью (рисунок 3.15) – в её узлах уже находятся ионы, молекулам растворителя нужно лишь вырвать их из кристаллической решетки. То есть, в этом случае отсутствует стадия поляризации, поэтому кристаллы с ионной связью диссоциируют быстрее и в большей степени, чем вещества с ковалентной полярной связью. Уравнение, которое описывает процесс диссоциации вещества с ионной связью, выглядит так: · KA+ (x+y)Sol D К+·xSol +А-·ySol - вместе с образованием сольватной оболочки происходит вырывание иона из узла кристаллической решетки. · KA+ (x+y)H2O D К+·x H2O +А-·yH2O – частный случай, взаимодействие частиц растворяемого вещества и воды. Эти взаимодействия обычно демонстрируют на примере диссоциации хлорида натрия (рисунок 6.4):
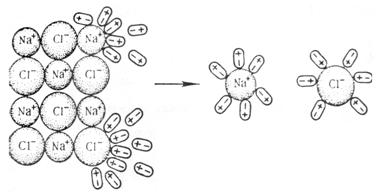
Рисунок 6.4. Электролитическая диссоциация вещества с ионной связью на примере NaCl. Таким образом, несложно придти к выводу о том, что причиной электролитической диссоциации является химическое взаимодействие между растворенным веществом и растворителем. Поскольку это взаимодействие, очевидно, зависит от природы растворенного вещества и растворителя (как и любая другая химическая реакция), то различные вещества в различных растворителях будут диссоциировать с различной степенью. Кроме того, из этих схем видно, что электролитической диссоциации подвергаются только вещества либо с полярной ковалентной связью, либо с ионной связью в полярных растворителях. Так что не следует ждать электролитической диссоциации хлорида натрия в неполярном бензоле (C6H6), либо неполярного пентана в воде. Еще одной особенностью процесса сольватации является то, что количество молекул растворителя в сольватной оболочке не является фиксированным, поэтому числа x и y в приведенных выше уравнениях переменные. Из-за этого их в уравнениях электролитической диссоциации часто опускают: KA+Sol D К+·Sol +А-·Sol Кроме того, далеко не всегда требуется отражение процесса сольватации, поэтому чаще всего пользуются уравнениями электролитической диссоциации из теории Аррениуса: КА D К++А-. Итак, раз электролиты диссоциируют с различной интенсивностью, то нужна количественная мера этого процесса. Величина, с помощью которой можно отличить сильный электролит от слабого. Это степень диссоциации (греч. α), которая показывает отношение количества диссоциировавших молекул вещества к общему количеству растворенного вещества:
где Nд – количество продиссоциировавших молекул электролита, Nо – общее количество молекул электролита. Как и любое другое соотношение, степень диссоциации можно выражать либо в долях, либо в процентах. Если степень диссоциации электролита равна 1 (или 100%), то такой электролит считается сильным. Если степень диссоциации электролита менее 1 (менее 100%), то такой электролит считается слабым. Сильные электролиты полностью диссоциируют в своих растворах, поэтому иногда бывает уместно в уравнении их диссоциации поставить знак необратимости: КА → К++А- Соответственно, слабые электролиты диссоциируют до установления некоторого равновесного состояния: КА D К++А- Степень диссоциации электролита зависит от природы растворителя и растворенного вещества, температуры, концентрации раствора и наличия одноименных ионов.
В общем случае, зависимость между степенью диссоциации и природой растворителя определяется его диэлектрической проницаемостью (ε). Сила притяжения между противоположными зарядами (ионами) по закону Кулона прямопропорциональна произведению величины зарядов (q) и обратна квадрату расстояния между ними (r):
Из этого закона видно, что чем выше диэлектрическая проницаемость среды, тем слабее притягиваются ионы растворенного вещества, и тем сильнее равновесие электролитической диссоциации смещено в сторону образования ионов. Например, если сравнивать воду с бензолом, их диэлектрическая проницаемость равна 78,25 и 2,27. Значит, в бензоле диссоциации электролита не произойдет. В химии под раствором обычно понимается водный раствор, поэтому электролиты делятся на слабые и сильные, по отношению к водным растворам: · К сильным электролитам в водных растворах относятся почти все соли, основания щелочных и щелочноземельных металлов, кислоты: H2SO4, HNO3, HCl, HBr, HI, HСlO4, HClO3, HBrO4, HBrO3, HIO3, H2SeO4, HMnO4, H2MnO4 и т.д. · К слабым электролитам относят воду, почти все органические кислоты (муравьиную, уксусную, бензойную и т.д.), ряд неорганических кислот (H2SO3, HNO2, H2CO3, H3AsO4, H3AsO3, H3BO3, H3PO4, H2SiO3, H2S, H2Se, H2Te, HF, HCN, HCNS), основания p-, d-, f- элементов (Al(OH)3, Cu(OH)2, Fe(OH)2 и т.д.), гидроксид аммония, гидроксиды магния и бериллия, некоторые соли (CdI2, CdCl2, HgCl2, Hg(CN)2, Fe(CNS)3 и т.д.). Тем не менее, необходимо помнить, что при замене воды на другой растворитель эти вещества будут диссоциировать по другому. Например, если вместо воды взять аммиак, то в нем все кислоты будут диссоциировать на 100% из-за химической реакции между аммиаком и кислотой. Поэтому понятия сильного и слабого электролита зависят от растворителя. Изменение температуры, концентрации электролита и концентрации одноименных ионов легко объясняется правилом Ле Шателье: · Влияние температуры обусловлено тепловым эффектом процесса растворения. Обычно при сольватации выделяется тепло, поэтому увеличение температуры уменьшает степень диссоциации сильных электролитов. У слабых электролитов с увеличением температуры степень диссоциации растет, а затем при достижении примерно 600С начинает уменьшаться. · Увеличение концентрации электролита приводит к тому, что степень диссоциации уменьшается. При увеличении числа ионов растет вероятность того, что они смогут притянуться друг к другу. Чем больше ионов в растворе, тем меньше расстояние между ними. И тем больше электрические силы притяжения между ионами, ведь они обратны квадрату расстояния между ними. · Если в растворе присутствуют одноименные ионы, то степень диссоциации электролита в таком растворе будет уменьшаться. Допустим, в растворе присутствуют азотистая кислота: HNO2 D H++NO2-, если в этот раствор добавить соль, содержащую одноименный анион (тот - же анион, что и в кислоте, нитрит-анион), например, нитрит калия KNO2, то в результате ее диссоциации: KNO2 D K++NO2-, концентрация нитрит-анионов NO2- возрастет, что, согласно принципу Ле Шателье сместит равновесие влево, то есть, в сторону уменьшения диссоциации. Необходимо отметить, что понятия хороший электролит и хорошая растворимость являются разными характеристиками, и могут не совпадать друг с другом. Например, растворимость уксусной кислоты (СН3СООН) в воде не ограничена, однако уксусная кислота относится к слабым электролитам. Или другой пример – сульфат бария (ВаSО4) – малорастворимая соль (при 20°С растворимость меньше 1 мг в 100 г воде), но относится к сильным электролитам, так как все молекулы, перешедшие в раствор, распадаются на ионы Ва2+ и SО42-.
Подведем промежуточный итог по этой части главы: некоторые вещества распадаются на ионы при растворении, вследствие чего изменяются экспериментальные коллигативные свойства. Такие растворы проводят электрически ток, и поэтому эти вещества называются электролитами. Процесс растворения обладает сложной природой, которую можно описать, объединив физические и химические представления. Количественной мерой процесса диссоциации является степень диссоциации, которая определяется природой взаимодействующих веществ, температурой и концентрацией.
Вопросы и задания для самоконтроля 1) Что такое процесс электролитической диссоциации? 2) Как диссоциируют вещества с различным типом химической связи? 3) Каковы положения теории диссоциации Аррениуса? 4) Какими недостатками обладает теория Аррениуса? 5) Как изменится степень диссоциации сильного электролита, если его растворить в неполярном органическом растворителе?
6.3.1. Растворы слабых электролитов.
Теперь необходимо поговорить о растворах слабых электролитов. Как уже было сказано выше, их процесс диссоциации является обратимым: КmАn D mКn+ + nАm- Следовательно, он, как и любой другой равновесный процесс, может быть охарактеризован с помощью константы равновесия – константы диссоциации[5]:
Довольно большое количество электролитов относится к т.н. бинарным электролитам – их молекулы состоят из 1 катиона и 1 аниона, соответственно, их уравнение диссоциации выглядит следующим образом: КА D К+ + А- Для бинарных электролитов выражение для константы диссоциации значительно упрощается:
Теперь, нужно вспомнить о том, что степень диссоциации – это отношение количества продиссоциировавших молекул к количеству растворенного вещества. Следовательно, можно выразить равновесные концентрации ионов как произведение степени диссоциации на концентрацию электролита:
А равновесная концентрация недиссоциированных молекул тогда будет выражена следующим образом:
Тогда выражение для константы равновесия примет следующий вид:
Для слабых электролитов можно считать, что их степень диссоциации настолько мала, что выражение (1-α)≈1, тогда в выражении для Kд можно сократить концентрацию и придти к т.н. закону разбавления Оствальда[6]:
Этот закон показывает, как степень диссоциации зависит от концентрации слабого электролита, очевидно, что для выполнения этого равенства, при увеличении концентрации (C↑) должна уменьшаться степень диссоциации (α↓). Кроме того, степень диссоциации слабого электролита можно связать с изотоническим коэффициентом. Фактически, изотонический коэффициент указывает на то, во сколько раз возросло число частиц в растворе после диссоциации. Пусть количество частиц в растворе было равно N, из которых на ионы продиссоциировало n частиц. При этом, при диссоциации образовалось ν ионов (например, для бинарного электролита, уравнение диссоциации которого было разобрано выше, ν=2, ведь при его диссоциации образовался 1 катион и 1 анион). Тогда, изотонический коэффициент должен вычисляться следующим образом:
Второе слагаемое – это количество частиц, которое образовалось в результате диссоциации, минус единица в нем появилась из-за того, что при диссоциации одна молекула распадается на ν ионов, то есть, сама-то молекула свое существование прекращает. Несложно видеть, что n/N в этой формуле не что иное, как степень диссоциации. Тогда, связь между изотоническим коэффициентом и степенью диссоциации принимает следующий вид:
где i – изотонический коэффициент, α – степень диссоциации, ν – количество ионов, на которое диссоциирует одна молекула электролита. Разумеется, определив экспериментально какое-либо коллигативное свойство раствора, можно вычислить экспериментальный изотонический коэффициент, а через него найти степень диссоциации вещества в растворе:
Примеры решения задач на изотонический коэффициент.
Задача 1. Вычислить давление насыщенного пара при 250С, для раствора бинарного электролита со степенью диссоциации 0,8. Мольная доля растворенного электролита – 10%. Решение: Для решения этой задачи потребуется первый закон Рауля, согласно которому относительное понижение давления насыщенного пара над раствором пропорционально мольной доле растворенного вещества. Так как приходится иметь дело с раствором электролита, то в эту формулу войдет изотонический коэффициент:
P нужно найти, P0 – справочная величина, для воды при 250С она равна 3,17 кПа, N – мольная доля, есть по условиям задачи, i – изотонический коэффициент, его нужно найти:
Теперь остается только подставить значение изотонического коэффициента:
Отсюда P = 2,59 кПа. Ответ: давление насыщенного пара над данным раствором равно 2,59 кПа.
Задача 2. Раствор некоторого электролита типа KA2 с моляльностью 0,1 моль/кг замерзает при температуре -0,20С. Вычислить степень диссоциации этого электролита. Решение: Степень диссоциации связана с изотоническим коэффициентом:
Из условий задачи ясно, что ν =1+2=3, так как уравнение диссоциации такого электролита: КА2 D К2++2А- Согласно второму закону Рауля изменение температуры замерзания раствора должна быть равна:
Но раствор электролита замерзает при температуре -0,20С. Отношение экспериментального ∆Ткр к теоретическому позволит вычислить изотонический коэффициент:
Осталось только подставить значение изотонического коэффициента в формулу для расчета степени диссоциации:
Ответ: степень диссоциации этого электролита равна 0,53.
6.3.2. Растворы сильных электролитов
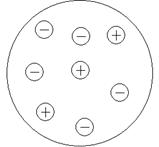
В растворах сильных электролитов имеется другая особенность. Из-за хорошей диссоциации вещества в растворе оказывается большое количество ионов. Расстояние между ними оказывается меньше, а сила взаимодействия между ионами обратно пропорциональна квадрату расстояния между ними. В результате, ионы, подошедшие друг к другу начинают взаимодействовать. Это взаимодействие приводит к тому, каждый ион в растворе оказывается окружен другими ионами (как ионами противоположного знака, которые притягиваются, так и ионами того – же знака, которые отталкиваются). Таким образом, вокруг каждого иона формируется ионная атмосфера, которая компенсирует заряд центрального иона (рисунок 6.5).
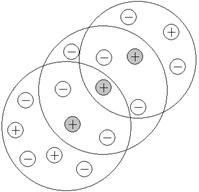
Рисунок 6.5 Модель ионной атмосферы. Разумеется, ионная атмосфера образуется вокруг каждого иона, поэтому каждый ион одновременно является частью нескольких ионных атмосфер, и, одновременно, создает свою собственную (рисунок 6.6)
Рисунок 6.6 Модель ионных атмосфер. Серым цветом выделены ионы, вокруг которых сформировались ионные атмосферы.
Следовательно, каждая ионная атмосфера, обладает характерными особенностями: • в их состав входят катионы и анионы, однако преобладают ионы, противоположные по знаку заряду центрального иона; • cуммарный заряд ионной атмосферы равен по величине заряду центрального иона и противоположен ему по знаку; • все ионы в растворе равноправны, поэтому каждый из них является центральным ионом и одновременно входит в состав ионной атмосферы другого иона; • за счет теплового движения ионы, входящие в состав ионной атмосферы, постоянно меняются местами с ионами, находящимися за ее пределами, т.е. ионная атмосфера носит динамический характер. И наличие ионных атмосфер вокруг каждого иона вносит свои коррективы в поведение ионов. Изменяются свойства растворов, которые связаны с подвижностью и доступностью ионов. Например, если в раствор опустить электроды, и наложить разность потенциалов, то центральный ион начнет двигаться в одну сторону, а его ионная атмосфера в другую. И так как ионная атмосфера притягивается своим центральным ионом, то ион и ионная атмосфера тормозят свое движение. В результате, в единицу времени через раствор переносится меньший электрический заряд, чем должен (рисунок 6.7):
Рисунок 6.7 Движение ионов в разные стороны. Кроме того, ионная атмосфера может не подпустить к центральному иону для другого участника химической реакции, поэтому в растворах, где присутствует ионная атмосфера, растворенные вещества вступают в химические реакции не всеми своими частицами, а только частью. Для того, что бы это учесть во всех формулах, где присутствует концентрация, строго говоря, должна стоять не сама молярная концентрация (C), а так называемая активность (α). Активность – это та концентрация вещества (или иона, или частицы), которой оно вступает в химические реакции. Активность рассчитывается из молярной концентрации с помощью, так называемого коэффициента активности (f):
Коэффициент активности, это безразмерная величина, характеризующая отклонение свойств раствора от аналогичного идеального раствора (в котором отсутствует межмолекулярное взаимодействие). Или, проще говоря, эта та доля частиц, которая реально вступит в химическую реакцию. Коэффициент активности зависит от природы растворителя и растворенного вещества, от заряда и природы иона, от концентрации раствора, от температуры. Однако, в разбавленных растворах (С ≤ 0,5 моль/л) природа иона слабо сказывается на значении f. Приближенно можно считать, что в разбавленных растворах коэффициент активности иона f в данном растворителе практически не зависит от природы иона, зависит только от заряда иона и ионной силы раствора I. Ионная сила – это мера интенсивности электрического поля, создаваемого ионами в растворе. Она высчитывается как полусумма произведений концентрации С каждого иона на квадрат его заряда z:
где n – количество содержащихся в растворе ионов. Коэффициент активности связан с ионной силой следующим соотношением:
Впрочем, чаще всего на практике приходится работать с настолько разбавленными растворами (например, пресные или ультрапресные природные воды, питьевая вода), что в них формируется очень слабая ионная атмосфера, и коэффициент активности приближается к 1, и в целом, можно считать, что активность равна концентрации. Более подробно о ионной силе и коэффициенте активности рассказывается в курсе физической химии, так что пока остановимся на этом.
Задания и вопросы для самоконтроля: 1) Как связана степень диссоциации слабого электролита с его концентрацией? 2) Как связан изотонический коэффициент со степенью диссоциации? 3) Какая особенность имеется у растворов сильных электролитов? 4) Каковы свойства ионной атмосферы? 5) Что такое активность? Почему её приходится вводить в формулы для расчетов, и как она высчитывается для разбавленных растворов? 6) Некоторый раствор электролита типа KAсодержит 0,1 моль вещества в 100 г воды. Его степень диссоциации равна 0,7. Чему равна температура замерзания этого раствора? Ответ: -3,160С 7) Мольная доля электролита типа K2A в водном растворе 0,1. Его степень диссоциации равна 0,5. Чему равно давление насыщенного пара над этим раствором при 250С? Ответ: 2,4 кПа.
6.4 Равновесия в растворах электролитов.
В этой части главы нужно поговорить о самом важном растворителе – воде, о том, как величины, применяемые к водным процессам, могут быть распространены на другие растворители, и о том, как можно охарактеризовать равновесие в системах «насыщенный раствор – вещество». Электролитической диссоциации подвергается не только растворяемое вещество, но и сам растворитель. Этот процесс можно охарактеризовать, с помощью таких величин, как константа диссоциации, ионное произведение, pH или pOH. В упрощенном виде процесс диссоциации воды можно представить следующим уравнением: H2ODH++OH- В результате этой диссоциации одна молекула воды «распадается» на катион водорода и гидроксид-анион. Причиной этого процесса являются другие молекулы воды, они «помогают» разрушить связь H-OH и сольватировать образовавшиеся ионы. Соответственно, этот процесс может быть запущен для любой молекулы воды (ну и в общем случае – для молекулы любого растворителя), поэтому он называется автопротолизом, либо в более широком смысле самоионизацией. Приставки «авто» и «само» указывают на то, что процесс протекает самопроизвольно, не требуя присутствия каких-либо других веществ, а «протолиз» – указывает на появление конкретного иона – катиона водорода (катион водорода H+ это не что иное, как протон без электрона). Как и любой другой равновесный процесс, автопротолиз может быть охарактеризован с помощью константы равновесия:
При 250С значение константы диссоциации воды Kд = 1,8×10-16, а равновесная концентрация воды [H2O] (фактически, молярная концентрация воды самой в себе) составляет 55,6 моль/л. Умножив обе части этого уравнения на значение [H2O] получится следующее выражение:
Эта величина 10-14 называется ионным произведением воды(Kw):
Так как ионное произведение выводится через константу равновесия, то именно оно определяет значение равновесных концентраций ионов. То есть, если поменяется концентрация катиона водорода, концентрация гидроксид-анионов изменится таким образом, что – бы их произведение снова оказалось равным ионному произведению. Вне зависимости от того, что происходит в водном растворе, при 250С Kw сохраняет свое значение 10-14. Однако пользоваться этой величиной из-за её степенного вида довольно неудобно, поэтому это выражение стоит прологарифмировать. Возьмем отрицательный десятичный логарифм:
Несложно видеть, что в левой части уравнения после логарифмирования останется 14, а в правой части можно произведение под логарифмом заменить суммой логарифмов:
Остается сделать финальный штрих. Отрицательный десятичный логарифм от какой-либо величины в химии называется показателем этой величины. Показатель обозначается буквой p перед обозначением величины. Таким образом, показатель ионного произведения Kw обозначается как pKw, показатель равновесной концентрации катионов водорода обозначается как pH, а показатель равновесной концентрации гидроксид-анионов pOH. И уравнение приобретает простой и понятный вид:
где, pKw – отрицательный десятичный логарифм от ионного произведения воды, при 250С он равен 14, рH – отрицательный десятичный логарифм от равновесной концентрации катионов водорода, а pOH – отрицательный десятичный логарифм от равновесной концентрации гидроксид-анионов. Если есть необходимость перевести показатель обратно в десятичный вид, то для этого, очевидно, нужно основание логарифма (10) возвести в отрицательную степень показателя, для приведенных выше величин:
А теперь нужно обратить внимание на значение pH и pOH. Уравнение автопротолиза воды указывает на то, что на один катион водорода приходится один гидроксид-анион, то есть, если на процесс автопротолиза воды не оказывается какого-либо воздействия другим химическим процессом, то эти концентрации должны быть равны [H+]=[OH-], следовательно, должны быть равны и соответствующие показатели pH=pOH, а раз их сумма при 250С равна 14, то становится очевидно, что если на равновесие автопротолиза воды не оказывается воздествие, то pH и pOH воды должны быть равны 7. Собственно, pH – это тот показатель, по которому определяют насколько смещено кислотно-основное равновесие в воде. Если на автопротолиз не оказывается постороннего воздействия, то pH раствора оказывается равным 7, в таких случаях говорят среда раствора нейтральная. Если концентрация катионов водорода в растворе [H+] начинает увеличиваться (например, в результате добавления кислоты), то значение pH будет уменьшаться (логарифм отрицательный), как говорят в таких случаях, среда раствора становится кислой – в ней повышено содержание катионов водорода, pH менее 7. Наоборот, если концентрация катионов водорода [H+] в растворе начнет уменьшаться, то значение pH будет увеличиваться, среда раствора становится щелочной – в ней понижено содержание катионов водорода, pH более 7. Аналогичные изменения происходят и с pOH, сумма pH и pOH для воды равна 14, поэтому, когда падает pH – растет pOH (кислая среда, pOH больше 7), и наоборот, когда растет pH – падает pOH (щелочная среда, pOH меньше 7). Получается, что для воды для описания смещения равновесия автопротолиза без разницы, какой из этих двух показателей, использовать, но почему – же тогда более распространено значение pH? Причины две, во-первых, теории кислот и оснований гораздо большее внимание уделяют катионам водорода, о чем будет рассказано в последующей главе, а во-вторых, это у воды вторым ионом является гидроксид-анион, а у других растворителей будут образовываться другие анионы, например, уравнение самоионизации аммиака: NH3 D H+ + NH2- Или, уравнение самоионизации этилового спирта: C2H5OH D C2H5O- + H+ Как видно из этих уравнений, анионы образуются в процессах самоионизации других веществ – другие. Кроме того, нейтральный уровень pH = 7 подходит только для воды и водных растворов, он определяется константой самоионизации, а константы других растворителей имеют другие значения. Для жидкого аммиака константа самоионизации равна 10-33(при -500С). Для этилового спирта константа самоиониации равна 10-19,1. Очевидно, что у этих растворителей значение нейтрального уровня pH будет иным. Поэтому для других растворителей можно использовать только рН, рОН не подходит, так как соответствующего иона при их диссоциации не образуется, а значение рН, описывающее нейтральную среду раствора (не смещенное равновесие самоионизации) не будет равно 7, у каждого растворителя это значение свое. Теперь нужно рассмотреть процессы, которые определяют растворимость того или иного вещества в воде. Логика описания этих процессов аналогична рассмотренным выше рассуждениям, отталкиваться снова придется от равновесного состояния. Итак, имеем некоторый ненасыщенный водный раствор сильного электролита КmАn, по мере добавления новых порций вещества они растворяются и диссоциируют: КmАn(тв)→ mКn+ + nАm- Состояние равновесия еще не достигнуто, поэтому каждая добавленная порция электролита растворяется и диссоциирует (так как он сильный, его степень диссоциации близка к 100%), поэтому в этом уравнении стоит знак необратимости. Тем не менее, бесконечно растворять электролит вода не в состоянии, рано или поздно наступит состояние насыщения – когда новые порции вещества перестанут растворяться. Нерастворенное вещество находится в состоянии равновесия с раствором (какие-то молекулы осадка переходят в раствор и диссоциируют, а вместо них ассоциируют другие растворенные молекулы электролита и выпадают в осадок), и уравнение, которое описывает состояние насыщения, будет выглядеть так: КmАn(тв)D mКn+ + nАm- Равновесный процесс характеризуется соответствующей константой равновесия:
Так как электролит образует конденсированную фазу (является твердым телом), то его равновесная концентрация принимается равной 1, тогда это выражение упрощается:
Константа равновесия, которая определяет произведение концентраций катионов и анионов электролита называется произведением растворимости. Произведение растворимости обозначается как ПР или Kпр. Так – же, как и ионное произведение воды определяет равновесные концентрации H+ и OH-, произведение растворимости определяет равновесные концентрации катионов и анионов при растворении электролита. То есть, именно значение ПР будет определять – растворится электролит в этом растворе, или нет: · Электролит будет растворяться в растворе до тех пор, пока произведение концентраций его ионов не окажется равным его ПР. Последующие порции электролита растворяться не будут. · Если произведение равновесных концентраций окажется больше ПР (например, в результате химической реакции в растворе появились вещество с меньшим ПР), то тогда это вещество будет выпадать в осадок до тех пор, пока произведение его ионов не уменьшиться до значения ПР – это и есть условие выпадения осадка. Таким образом, значение ПР определяет тип раствора: · Если ПР больше произведения равновесных концентраций ионов этого электролита – то это ненасыщенный раствор, новые порции электролита будут растворяться в этом растворе:
· Если ПР равно произведению равновесных концентраций ионов этого электролита – то это насыщенный раствор, его концентрация равна растворимости электролита. Новые порции электролита, добавленные в раствор, не будут растворяться:
· Если ПР меньше произведения равновесных концентраций ионов этого электролита – то это пересыщенный раствор, который является нестабильным. Для него выполнено условие выпадения осадка, и из такого раствора электролит будет выпадать до тех пор, пока произведение равновесных концентраций ионов электролита не уменьшится до значения ПР:
Помимо этого, ПР еще и дает возможность рассчитать растворимость одного вещества, если в растворе присутствует другое вещество, с тем – же ионом. Например, ПР сульфата кальция составляет 2,5×10-5 Он диссоциирует по следующему уравнению: CaSO4DCa2+ + SO42- Если в растворе нет других источников катиона кальция или сульфат-аниона, то растворимость сульфата кальция будет равна квадратному корню из его ПР (так как по уравнению реакции ν(CaSO4) = ν(Ca2+ ) = ν(SO42-), а, значит, и концентрация растворенного сульфата кальция равна равновесным концентрациям его ионов C(CaSO4)=[Ca2+ ]=[ SO42-] ):
Откуда C(CaSO4)=0,005 моль/л, или 0,68 грамм/л. Теперь, допустим, в растворе имеется 0,0025 моль/л катиона кальция, тогда уравнение примет следующий вид:
Пусть растворимость C(CaSO4)=х, тогда имеем:
Дискриминант этого квадратного уравнения:
Корни уравнения:
Второй корень в данном случае не имеет значения, так как он отрицателен, тем не менее:
Таким образом, в растворе, который содержит 0,0025 моль/л катионов кальция растворимость сульфата кальция составит 0,0375 моль/л, или 0,51 грамм/л. На этом принципе основан один из методов выделения малорастворимого вещества из раствора. К раствору, который содержит малорастворимый электролит (например, тот – же CaSO4) добавляют хорошо растворимый электролит с общим ионом (допустим, CaCl2, в этом примере общим ионом окажется катион кальция). Это приводит к тому, что растворимость первого электролита уменьшается (как показывают расчеты выше, при увеличении концентрации катиона кальция на 0,0025 моль/л растворимость CaSO4 падает с 0,68 г/л до 0,51 г/л) и в соответствии со значением ПР, произойдет выпадение в осадок малорастворимого электролита. Такой метод называется высаливанием. Высаливание – это выделение малорастворимого электролита из его раствора в осадок при добавлении к этому раствору хорошо растворимого электролита с общим ионом. Подведем итог по 6й главе. Поскольку индивидуальных веществ в нашей Вселенной по законам термодинамики не существует, на практике приходится иметь дело с дисперсными системами, из которых для химии наибольшее значение имеет растворы. В растворе можно попытаться выделить растворитель и растворенное вещество, но далеко не всегда это возможно. Любой раствор обладает коллигативными свойствами, которые зависят только от количества растворенных частиц. Коллигативные свойства описываются I и II законами Рауля и законом Вант-Гоффа. Однако, из-за существования такого явления как электролитическая диссоциация, которая приводит к распаду растворяемого вещества на ионы, количество частиц в растворе увеличивается, и в эти законы приходится вносить поправку. Количественной мерой электролитической диссоциации служит степень диссоциации, которая связана с константой диссоциации. В растворах электролитов образуется ионная атмосфера, которая мешает протеканию электрохимических и химических процессов, поэтому для растворов сильных электролитов приходится вводить понятие активности. Электролитическая диссоциация происходит и в растворителях, поэтому приходится вводить понятие рН для характеристики смещения этого равновесного процесса и вытекающих из этого свойств раствора. Кроме того, через значение константы электролитической диссоциации электролита можно рассчитать его произведение растворимости, что позволяет определить его растворимость в различных условиях.
Задания и вопросы для самоконтроля: 1) Что такое автопртолиз, с помошью какой величины его можно описать? 2) Что такое рН и рОН, насколько применимы эти величины к характеристике неводных растворов? 3) Что такое произведение растворимости? 4) Как величина ПР определяет тип раствора? 5) Как влияет присутствие других электролитов на ПР вещества? На растворимость вещества? 6) При некоторой температуре растворимость карбоната серебра равна 10-4 моль/л. Рассчитать ПР этой соли. Ответ: ПР = 4×10-12. 7) Смешали 150 мл 0,2 М раствора FeCl2 и 350 мл 0,01 М раствора NaOH. Выпадет ли осадок Fe(OH)2, если ПР(Fe(OH)2) = 1,6×10–15. Изменением объема раствора пренебречь. Ответ: осадок выпадет.
Глава ?. Основные классы неорганических веществ и их химические свойства.
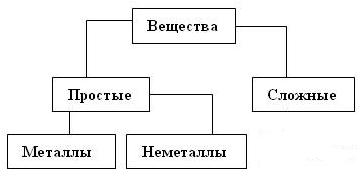
Не сложно догадаться, что в химии все абстрактные индивидуальные вещества делятся на классы в соответствии с их химическими свойствами, которые определяют поведение вещества в химической реакции. А поскольку химические свойства определяются атомным составом молекулы (кристалла), то классификация неорганических веществ основана именно на химическом составе. Первое деление всех индивидуальных веществ в нашей Вселенной дает два класса веществ: простые и сложные. Простые вещества состоят из атомов одного химического элемента. Соответственно сложные вещества состоят из атомов разных элементов. Очевидно, что эти два класса веществ неравноценны, вариантов сложных веществ неизмеримо больше чем простых. Именно что неизмеримо больше. Потенциально, количество одних только органических веществ не ограничено. Начнем строить схему этой классификации (рисунок 5.1)
Рисунок 5.1. Деление веществ на простые и сложные. Ранее, во второй главе, были описаны те физические величины, с помощью которых может быть охарактеризован атом: атомный радиус, энергия ионизации, энергия сродства к электрону, электроотрицательность. Атомы, имеющие большой атомный радиус, малые энергии ионизации и сродства к электрону, низкую электроотрицательность, легко отдают свои электроны в химических реакциях. Эти элементы называются металлами. Атомы с противоположными свойствами в химических реакциях присоединяют электроны. Такие элементы называются неметаллы. Поскольку простое вещество состоит из атомов одного элемента, то оно тоже является металлом либо неметаллом. Дополняем схему, разделив простые вещества на металлы и неметаллы (рисунок 5.2)
Рисунок 5.2. Деление простых веществ на металлы и неметаллы. Для металлов характерна металлическая связь, соответственно многие металлы обладают металлическим блеском, прочностью, ковкостью, гибкостью, хорошей теплопроводностью и электропроводностью. При комнатной температуре почти все металлы являются кристаллами. Исключением из этого правила является ртуть. Что касается химических свойств, то металлы в химических реакциях отдают свои электроны. Впрочем, эта способность сильно зависит от природы металла. Щелочные металлы настолько активно отдают свои электроны, что способны восстанавливать водород из воды. При проведении реакции между металлическим калием и водой весьма вероятен взрыв: 2K+H2O→2KOH+H2↑ Некоторые металлы являются активными, но на их поверхности образуется защитная плёнка, которая мешает им проявлять свои свойства. Например, алюминий является довольно активным металлом, но из-за наличия защитной оксидной плёнки на его поверхности просто так он в химическую реакцию не вступит. Другие металлы, например, ртуть свои электроны отдают очень неохотно. У ртути валентные электроны находятся на 6s подуровне, но по правилу Клечковского этот подуровень находится под двумя другими 5d и 4f, которые у ртути полностью заполнены электронами. Свойства неметаллов противоположны: их кристаллы обычно хрупкие, плохо проводят электрический ток и тепло, не обладают металлическим блеском. При стандартных условиях часть неметаллов является газами. В химических реакциях неметаллы присоединяют электроны. Опять – же, способность присоединять электроны зависит от природы неметалла. Самым активным неметаллом является фтор, со многими веществами он реагирует со взрывом, и в его атмосфере даже вода горит синим пламенем: 2F2+2H2O→4HF+O2 Из-за его высокой химической активности многие попытки выделить фтор в чистом виде оканчивались, в лучшем случае отрицательным результатом, в худшем – увечьями. С другой стороны водород относится к неметаллам, но свои неметаллические свойства он может проявить только в т.н. гидридах щелочных металлов – соединений водорода и металлов I группы периодической таблицы. Только от очень активного донора водород может стянуть по химической связи общую пару электронов, тем самым, доказав свою природу неметалла. Сложные вещества делятся на оксиды, гидроксиды
Список литературы
1. Рудзитис Г.Е. Химия. Неорганическая химия. 8 класс: учебник для общеобразовательных учреждений с приложением на электронных носителях / Г.Е. Рудзитис, Ф.Г. Фельдман. – 15е изд. – М.: Просвещение, 2011. – 176 с. 2. Кузнецова Н.Е. Химия: 8 класс: учебник для учащихся общеобразовательных учреждений / Н.Е. Кузнецова, И.М. Титова, Н.Н. Гара. – 4е изд., перераб. – М.: Вентана-Граф, 2012. – 256 с. 3. Габриелян О.С. Химия. 8 класс: учебник для общеобразовательных учреждений / О.С. Габриелян. – 2е изд.,стереотип. – М.: Дрофа, 2013. – 286 с. 4. Гузей Л.С. Химия. 8 кл: Учебник для общеобразовательных учреждений / Гузей Л.С., Сорокин В.В., Суровцева Р.П. – М: Дрофа, 2003. – 285 с. 5. Цветков 6. Ахметов 7. https://ru.wikipedia.org/wikiХимия 8. http://www.xumuk.ru/encyklopedia/2/4995.html 9. Глинка Н.Л. Общая химия. Учебное пособие для вузов / Н.Л.Глинка, ред. А.И Ермаков. – 30е изд., испр. – М.: Интеграл-Пресс, 2003. – 768 с. 10. http://www.medical-enc.ru/m/15/proton.shtml 11. http://dic.academic.ru/ 12. http://www.xumuk.ru/encyklopedia/721.html 13. http://www.alhimik.ru/teleclass/azbuka/1gl.shtml 14. http://allforchildren.ru/why/whatis7.php 15. http://www.hemi.nsu.ru/ucheb111.htm 16. С 17. Бронштейн М.Г. Атомы и электроны / Бронштейн М.Г. – М.: Наука. 1984. – 152 с. 18. Лукьянов А.Б. Физическая и коллоидная химия: учебник для техникумов. / А.Б. Лукьянов. – 2е изд. – М.: Химия, 1988. – 288 с. 19. Дикерсон Р. Основные законы химии: В 2 томах. / Р. Дикерсон, Г. Грей, Дж. Хейт. — М.: Мир. 1982. – 652 с. 20. Рыжакова Н.К. Ядерная физика и её приложения: учебное пособие / Н.К. Рыжакова. – 2е изд. – Томск: Изд-во Томского политехнического университета, 2008. -276 с. 21. Кабардин О. Ф. Физика: Справ. материалы: Учеб. пособие для учащихся. / О.Ф. Кабардин — 3-е изд. — М.: Просвещение, 1991.— 367 с. 22. Киреев В.А. Краткий курс физической химии. / В.А. Киреев. 3-е изд., перераб. и доп. — М.: Химия, 1975. — 776 с. 23. Основы физической химии. Теория и задачи. / В.В. Еремин, С.И. Каргов, И.А. Успенская и др. — М.: Изд-во Экзамен, 2005. — 480 с. 24. Тюрин Ю.И., Чернов И.П., Крючков Ю.Ю. Физика. Часть 3. Оптика. Квантовая физика: учебное пособие для технических университетов. / Ю.И. Тюрин, И.П. Чернов, Ю.Ю. Крючков – Томск: Изд-во Томского ун-та, 2004. – 738 с. 25. Сивухин Д.В. Общий курс физики / Д.В. Сивухин — М., 2005. — С. 226. 26. Кузьменко Н.Е. Химия. Для школьников старших классов и поступающих в вузы. / Н.Е. Кузьменко, В.В. Еремин, В.А. Попков– М.: МГУ – 1995. – 527с. 27. Стромберг 28. Севастьянова Г.К. Общая химия: Курс лекций. / Г.К. Севастьянова, Т.М. Карнаухова– Тюмень: ТюмГНГУ – 2005. – 210 с. 29. Дикерсон Р. Основные законы химии. В 2х томах. / Р. Дикерсон, Г. Грей, Дж. Хейт – М.: Мир – 1982. – 652 с. 30. Физика: Школьный курс. / В.А.Орлов, Г.Г. Никифоров, А.А. Фадеева и др. – М.: АСТ-ПРЕСС – 2000. – 688 с. 31. Мякишев Г.Я. Физика. 10 класс: учебник для общеобразовательных организаций с приложением на электронном носителе. / Г.Я. Мякишев, Б.Б. Буховский, Н.Н. Сотский; под ред. Н.А. Парфентьевой. – М.: Просвещение – 2014. – 416 с. 32. Овчинников В.А. Основные понятия термодинамики [Электронный ресурс]. / В.А. Овчинников. – М.: МФТИ. Режим доступа: http://lectoriy.mipt.ru/course/Physics-Thermodynamics-09L#about 33. Булат П.В. Обзор проектов детонационных двигателей. Импульсные двигатели. / П.В. Булат, Н.В. Продан // Фундаментальные исследования. – 2013. – № 10-8. – С. 1667-1671. 34. Гинденбург (дирижабль) [Электронный ресурс] // Wikipedia. Режим доступа: https://ru.wikipedia.org/wiki/Гинденбург_(дирижабль) 35. Биохимия. Учебник для вузов. / под ред. С.Е. Северина – М.: ГЭОТАР-МЕД – 2003. – 779 с. 36. Паничев С.А. Общая химия. / С.А. Паничев, Н.А. Хритохин, Л.П. Паничева. – Тюмень: ТюмГУ – 2001. – 412 с. 37. Менделеев Д.И. Растворы. / Д.И. Менделеев, под ред. К.П. Мищенко. – Л.: АНСССР. – 1959. – 1164 с. 38. Чикер Н.П. Служба особого назначения. Хроника героических дел. / Н.П. Чикер. – М.: Изд-во ДОСААФ. – 1975. – 224 с. [1] Следовательно, химическая реакция, как и любой другой процесс, может начинаться, протекать, завершаться, иметь направление или путь. В русском языке к описанию химической реакции применимы те – же определения, что и для любого другого процесса. [2] Что достаточно легко демонстрируется, возьмем два шара одинакового объема и разделим один из них на несколько фрагментов. Очевидно, что у фрагментов суммарная площадь поверхности больше, чем у исходного шара, и чем меньше фрагменты – тем больше их суммарная площадь. [3]Не забываем о том, что фактор эквивалентности представляется в виде простой дроби, фактически молярная концентрация умножается на количество условных частиц-эквивалентов, полученных из 1 молекулы вещества. То есть, нормальность больше либо равна молярности. [4] Например, с помощью поршня, который будет давить на концентрированный раствор. [5] Необходимо отметить, что, как и любая другая константа равновесия, константа диссоциации задает распределение равновесных концентраций ионов и недиссоциированного электролита, а не наоборот. [6] Название этого закона связано с тем, что во время его открытия пользовались в расчетах не концентрацией, а обратной величиной – разбавлением, котрое показывало, во сколько раз был разбавлен раствор. |
||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 291. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |