
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
III. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность.Стр 1 из 4Следующая ⇒ I. Химическая связь образуется двумя валентными электронами различных атомов с антипараллельными спинами. При этом происходит перекрывание электронных облаков и между атомами возникает зона с повышенной электронной плотностью. Это приводит к уменьшению потенциальной энергии системы. Обычно эти процессы иллюстрируются на примере молекулы водорода, которая состоит из двух атомов (рисунок 3.2):
Рисунок 3.2. Образование химической связи между атомами водорода. У двух атомов водорода имеется некий запас энергии, который на этой диаграмме условно обозначен нулевым (0). Пока атомы находятся далеко друг от друга, и их электронные облака не взаимодействуют, этот уровень энергии не меняется (правая часть диаграммы). По мере сближения атомов их электронные облака начинают взаимодействовать, при этом меняется движение электронов, расположенных на этих облаках. В итоге это сближение приводит к слиянию (т.н. «перекрыванию») двух электронных облаков и образования нового, общего на два атома. Для этого общего, молекулярного облака действуют те – же правила, что и для обычной атомной орбитали (принцип наименьшей энергии, запрет Паули). При формировании этого облака меняется и значение волновой функции электронов: если ранее электроны на одинаковом расстоянии от ядра можно было найти с одинаковой вероятностью, то теперь большую часть времени они проводят между двумя ядрами, формируя общую электронную пару (рисунок 3.3) [28]:
Рисунок 3.3. Перекрывание электронных облаков.
На этом рисунке общая электронная пара находится в области перекрывания (заштрихованная область).  При образовании общей электронной пары падает уровень энергии, поэтому, согласно принципу минимума энергии, такой процесс является выгодным. Однако, сближение атомов не происходит бесконечно. На некотором расстоянии силы отталкивания ядер атомов (ядра заряжены положительно, а одноименные заряды отталкиваются) уравновесят процесс дальнейшего слияния электронных облаков (на рисунке 3.2 это состояние соответствует минимуму энергии, т.н. «потенциальной яме»). При попытке дальнейшего сближения, из-за действия сил отталкивания будет резко возрастать уровень энергии (левая часть рисунка 3.2). Это равновесное расстояние между двумя центрами ядер называется длиной связи (l). Длина связи обычно измеряется в нанометрах (нм, 10-9м) или ангстремах (Å, 10-10м). Та энергия, которая выделяется атомами при формировании химической связи, называется энергией связи (Есв). Энергия связи измеряется в Дж/моль, либо Эв/моль. Эта величина характеризует прочность химической связи. Если мы хотим разделить атомы, разрушить химическую связь, то это количество энергии мы должны сообщить молекуле. Поэтому энергию связи можно определять двояко: это и то количество энергии, которое выделяется при формировании химической связи, и то количество энергии, которое нужно затратить на разрушение этой связи. Ниже приведены длины связей и их энергии для некоторых простых веществ (таблица 3.1): Таблица 3.1. Энергия и длины связей некоторых веществ
Как уже было сказано выше, молекулярное облако подчиняется запрету Паули. Следовательно, на этом облаке не могут находиться два электрона с одинаковым спином. При сближении атомов, электроны которых имеют одинаковый спин, не произойдет перекрывания электронных облаков, а энергия такой структуры будет расти. Это проиллюстрировано ниже (рисунок 3.4):
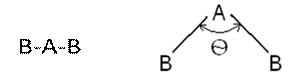
Рисунок 3.4. Перекрывание электронных облаков. Случай 1 – перекрывание электронных облаков, электроны которых имеют разный (антипараллельный) спин. Случай 2 – отталкивание электронных облаков, электроны которых имеют одинаковый (параллельный) спин. Как видно из этой диаграммы, в первом случае процесс энергетически выгоден, и химическая связь образуется, во втором процесс сближения энергетически невыгоден, и химическая связь не формируется. Кроме того, из первого положения видно, что химическая связь является результатом взаимодействия и электронов, которые формируют новое электронное облако, и протонов, вокруг электрического поля которых, происходит формирование этого облака. В приведенном выше примере не имеет значения, в каком направлении производить перекрывание, у двух s-облаков, имеющих форму шара, все направления перекрывания будут равноценны. Однако, если у атома имеются облака другой формы, то направление их перекрывания начинает играть важную роль, что отражается вторым положением МВС. II. В пространстве связь располагается по направлению, в котором возможность перекрывания электронных облаков наибольшая. Из второго положения следует, что существуют определенные способы перекрывания электронных облаков, отличающиеся направлением. А, значит, у химической связи есть такая характеристика, как валентный угол. Валентный угол (θ) – это угол между прямыми, соединяющими центры ядер атомов в молекуле. Величина валентного угла зависит от электронной конфигурации атомов, входящих в состав молекулы. У молекул, которые состоят из 2 атомов валентный угол, очевидно, равен 1800, а такая молекула имеет форму линии (обладает линейной конфигурацией). Но если молекула состоит уже из трёх атомов, то появляется два варианта её пространственной конфигурации: линейная и угловая (рисунок 3.5):
Рисунок 3.5. Линейная и угловая конфигурация трёхатомной молекулы. У линейной молекулы валентный угол равен 1800, а у угловой зависит от природы атомов A и B. III. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность. Третье положение вводит определение термину валентность. Здесь нужно обратить внимание на очередное отличие от школьного определения валентности. Согласно школьным учебникам валентность – это способность атома химического элемента присоединять или замещать определенное количество атомов другого элемента [1-6]. Пользуясь только этим определением, остается только заучивать валентности всех используемых элементов, а ведь многие из них еще и переменную валентность имеют. А пользуясь третьим положением МВС достаточно лишь знать количество протонов в ядре атома. Знаем количество протонов – можем описать электронную конфигурацию – видим, сколько электронов атом готов отдать на образование химической связи. Итак, химическая связь образуется при взаимодействии двух электронных облаков, с образованием общей электронной пары. Но между атомами может сформироваться не одна общая электронная пара, а несколько. В таком случае и химические свойства у такой связи будут другими. Химические связи, образованные несколькими электронными парами называются кратными (двойными и тройными, по количеству общих пар). Для обозначения химической связи используются два способа: либо отмечается сама химическая связь валентным штрихом «-», либо пара электронов, которая эту связь сформировала «:». Двойная связь обозначается двумя валентными штрихами «=», либо двумя парами электронов «::». Тройная – тройным валентным штрихом «≡», либо тремя парами «:::». При изображении химической связи валентным штрихом отличия в изображении валентных штрихов (разные длина, ширина, угол) не имеют значения. В таблице 3.2 приведены примеры обозначения химических связей. Таблица 3.2. Обозначение химических связей
Если принято решение использовать точки для обозначения электронов, то, как правило, указываются не только участвующие в формировании химической связи электроны, но и электроны атомов, находящиеся на валентном уровне. Такая запись называется формулой Льюиса. По фамилии ученого, который впервые высказал идею о формировании химической связи парой электронов. Пример образования химической связи, который подробно рассмотрен выше описывает процесс образования ковалентной связи по обменному механизму. Химическая связь между атомами, осуществляемая обобществленными электронами, называется ковалентной. Ковалентная связь (означает – «совместно действующая») возникает за счет образования общих электронных пар между атомами в молекуле. Ковалентная связь может быть образована по двум механизмам: 1) обменный; 2) донорно-акцепторный. Обменный механизм заключается в том, что каждый из участвующих атомов для образования общей электронной пары отдает по одному электрону. При этом происходит перекрывание электронных облаков, уменьшается энергия системы на величину энергии связи. С использованием формул Льюиса можно описать обменный механизм образования ковалентной связи для общего случая следующим уравнением: А·+·В®A:B В левой части этого уравнения есть два атома А и В. У них имеется по одному электрону, что и отображено точками «·». При взаимодействии этих двух атомов, за счет их электронов, образуется общая электронная пара «:», и формируется химическая связь. А сейчас ещё раз внимательно посмотрим на определение ковалентной связи атома: для её образования нужны два электрона и две атомных орбитали. Но в определении нет указания на то, общая пара электронов обязательно должна формироваться за счет электронов двух атомов. Ковалентная связь может возникнуть и в том случае, если один атом (донор) пожертвует имеющуюся у него пару электронов, а второй атом (акцептор, to accept(англ.) - принимать) её примет на свободную орбиталь (она – же вакантная орбиталь и лакуна). Это – донорно-акцепторный механизм образования ковалентной связи: D: + В этом уравнении D – донор с парой электронов (:), A – акцептор, имеющий лакуну ( Обычно в качестве примера этих двух механизмов возникновения химической связи приводится процесс образования катиона аммония (NH4+). Эта частица образуется при взаимодействии катиона водорода (H+) и молекулы аммиака (NH3). Для начала опишем процесс образования молекулы аммиака. У атома азота имеется 3 неспареных электрона на валентном уровне, которые и будут использованы для образования общих пар с атомами водорода. Значит, валентность азота равна III. 7N 1s2 У атома водорода на валентном уровне только один электрон. Его валентность равна I. 1H 1s1 Следовательно, атом азота образует три связи с тремя атомами водорода по обменному механизму:
У атома азота в составе молекулы аммиака остается пара электронов. Именно на неё и претендует катион водорода(H+), у которого нет ни одного электрона: 1H+ 1s1 И взаимодействие между катионом водорода и молекулой аммиака протекает по донорно-акцепторному механизму:
Что интересно, в этом катионе аммония положительный заряд равномерно распределен по всей частице, и это не смотря на то, что три связи с водородом образованы по обменному механизму, а четвертая по донорно-акцепторному. Ковалентная связь обладает рядом характерных свойств: • насыщаемостью; • направленностью; • полярностью и поляризуемостью Под насыщаемостью подразумевается способность атома образовывать ограниченное количество связей, в соответствии с его валентностью. При этом на образование химической связи тратятся все неспаренные электроны, которые имеются у атома. Вернёмся к примеру молекулы аммиака: У атома азота 3 неспареных электрона на валентном уровне 2p3: 7N 1s2 У атома водорода на валентном уровне только один электрон 1s1: 1H 1s1 Следовательно, атом азота образует три химические связи, а водород одну. Значит, в молекуле аммиака должно быть 3 атома водорода и 1 атом азота, формула аммиака NH3. Так вот, в соответствии со свойством насыщаемости, атом азота обязан использовать все свои неспаренные электроны. Поэтому соединений состава NH (азот отдал 1 электрон) или NH2 (азот отдал 2 электрона из 3х) не существует. Равно как и не существует соединений состава NH6 или NH7. Нет на валентном уровне у азота столько электронов, их всего – лишь 5. Количество образуемых по обменному механизму ковалентных связей определяется электронной конфигурацией атома - количеством неспаренных электронов, и при этом атомом используются все неспаренные электроны. Однако, так как процесс образования химических связей атому энергетически выгоден, то атом может увеличить количество неспареных электронов за счет своих электронных пар с валентного уровня. Да, для этого процесса, называемого промотированием, придется потратить некое количество энергии, но энергетический эффект от образования большего количества химических связей эти затраты окупит. Такая своеобразная инвестиция. Обычно этот процесс рассматривается на примере атома углерода. В невозбужденном состоянии атом углерода имеет только два неспаренных электрона: 6C 1s2 Следовательно, должны существовать молекулы веществ, в которых валентность углерода равна II. И действительно, существует оксид углерода C=O. Его называют оксид углерода (II). Но в пределах 2го энергетического уровня можно провести промотирование. Один из электронов с 2s орбитали можно отправить на свободную p-орбиталь:
6C 1s2 В результате промотирования (показано стрелкой), атом углерода переходит в возбужденное состояние. Атомы, находящиеся в возбужденном состоянии помечают звездочкой, в данном примере С*. 6C* 1s2 В возбужденном состоянии атом углерода имеет уже 4 неспаренных электрона, и его валентность равна IV. Поэтому кроме оксида углерода (II) с формулой CO, существует еще оксид углерода (IV) с формулой CO2. Химические связи в нем формируются вот так: O=C=O. Но далеко не все атомы способны производить промотирование электрона. Промотироване возможно в том случае, если орбитали, участвующие в этом процессе, близки по энергии. Для иллюстрации этого примера возьмем два электронных аналога – кислород и серу. У этих атомов одинаковое количество неспаренных электронов на валентных уровнях: 8O 1s2 16S 1s2 Но у кислорода нет возможности промотирования электронов, а у серы есть. Над 2p подуровнем находится 3s подуровень. И эти подуровни принадлежат разным энергетическим уровням (разное главное квантовое число). Поэтому промотирование электрона с 2p подуровня на 3s подуровень энергетически невыгодно. Энергии придется затратить слишком много, и эти затраты не окупятся образованием новой химической связи. Получается, что валентность кислорода может быть равна только II.
8O 1s2 Теперь посмотрим на электронную конфигурацию серы. Третий энергетический уровень не оканчивается на 3p-подуровне. На этом уровне существует еще 3d-подуровень с 5 свободными атомными орбиталями. И атом серы может промотировать на них либо один электрон с 3p-подуровня:
16S 1s2 И получить электронную конфигурацию с 4 неспаренными электронами, валентность атома серы в этом состоянии будет равна IV: 16S* 1s2 Либо повторить эту процедуру еще раз и получить 6 неспаренных электронов, и, соответственно, валентность равную VI:
16S* 1s2 16S* 1s2 Вот и получается, что у кислорода валентность может быть равна II, а у серы валентность переменная – может быть равна II, IV и VI. Постоянную валентность проявляют только s-элементы (а их всего известно 12) и два элемента второго периода O, F. У остальных элементов валентность переменная. Очевидно, что проще описать конфигурацию валентного уровня, благо их не много, и они повторяются, чем заучивать переменные валентности для остальных элементов, ведь их еще где-то около 100. Итак, суммарная валентность элемента равна сумме неспаренных электронов и числа связей, образованных по донорно-акцепторному механизму. В общем случае, максимально возможная валентность равна количеству электронов на валенном уровне, и его всегда можно подсмотреть в периодической таблице – это номер группы. Согласно второму положению МВС перекрывание электронных облаков происходит по определенным направлениям в пространстве: раз электронные облака имеют определенную форму, то их максимальное перекрывание можно осуществить, только расположив их друг по отношению к другу определенным образом. Придать облакам определенную пространственную ориентацию. В этом и заключается свойство направленности ковалентной связи – максимальное перекрывание валентных электронных облаков взаимодействующих атомов возможно при определенной их взаимной ориентации. Следовательно, направление перекрывания электронных облаков будет определять форму молекулы. В зависимости от того, как ориентируются электронные облака при перекрывании, различают 3 вида химической связи. Их обозначают буквами греческого алфавита: σ (сигма), π(пи) и δ(дельта) связи. Первый тип химической связи, σ-связь возникает когда перекрывание двух облаков происходит вдоль прямой, соединяющей центры двух атомов. Для такого перекрывания подойдут электронные облака любой формы (рисунок 3.5):
Рисунок 3.5. Образование σ-связей. На этом рисунке видно, что такое перекрывание может быть сформировано двумя s-облаками (а), s- и p-о облаками (б), двумя p- облаками (в) и двумя d- облаками (г). При таком расположении электронных облаков достигается максимально возможная степень их перекрывания. Поэтому из всех видов химических связей σ-связь является самой прочной, у неё наибольшая энергия связи, а, значит, такая ковалентная связь образуется первой. Под одинарным валентным штрихом в химических формулах скрывается именно она: H-H (рисунок 3.5, а), H-Cl (рисунок 3.5, б), Cl-Cl (рисунок 3.5, в). Второй тип химической связи, π-связь возникает когда перекрывание электронных облаков происходит по обе стороны прямой, соединяющей центры двух атомов. Для такого перекрывания s-облако уже не подходит, степень перекрывания получится слишком маленькой. Такая связь может образоваться в результате перекрывания d- и f-облаков (рисунок 3.6):
Рисунок 3.6. Образование π-связей. Этот тип связи обладает меньшей степенью перекрывания электронных облаков, чем σ-связь, а, следовательно, меньшей энергией связи. Поэтому π-связь формирует только после того, как будут исчерпаны возможности по формированию σ-связи. То есть, π-связи встречаются только в кратных химических связях, двойных и тройных. Например, молекуле C=O имеется двойная связь. Одна из них σ-связь, другая π-связь. В молекуле азота с тройной связью N≡N одна σ-связь и две π-связи. Энергия π-связи меньше, чем энергия σ-связи, но так как энергия двойной связи складывается из энергии σ-связи и π-связи, то суммарная энергия двойной связи больше чем энергия одинарной. Аналогично, раз тройная связь формируется одной σ-связью и двумя π-связи, то её энергия связи складывается уже из трёх составляющих: энергии σ-связьи и двух энергий π-связей. Поэтому энергия тройной связи больше, чем энергия двойной связи: E-<E=<E≡. Связи типа δ образуются при боковом перекрывании всех четырех «лепестков» d-облаков (рисунок 3.7):
Рисунок 3.7. Боковое перекрывание d-облаков. Очевидно, облака s и p не могут участвовать в формировании δ-связей. Общая пара электронов, за счет которой формируется химическая связь, не обязательно находится посередине между двумя атомами. Ядра атомов, будучи положительно заряженными, тянут общую электронную пару к себе. Получается своеобразное соревнование по перетягиванию каната, где в роли спортсменов выступают атомные ядра, а в роли каната – общая электронная пара. Мерой силы атомов в этом соревновании является их электроотрицательность: Если силы спортсменов одинаковы (одинаковая электроотрицательность у атомов), то и канат не перемещается – атомы тянут электронную пару к себе с одинаковой силой, и она остается ровно посередине между ними. В результате электрический заряд такой химической связи не меняется. Такая связь называется ковалентной неполярной. Ковалентная неполярная связь образуется, если атомы принадлежат к одному элементу а, значит, у них одинаковая электроотрицательность. Если силы спортсменов неравны (различная электроотрицательность у атомов), то канат перетягивается в сторону сильного спортсмена – электронная пара смещается в сторону более электроотрицтального атома. В результате у химической связи появляются два полюса: положительный (менее электроотрицательный атом, потерявший отрицательную электронную пару) и отрицательный (более электроотрицательный атом, стянувший к себе отрицательную электронную пару). Ковалентная связь называется полярной, если общая электронная пара смещена в сторону более электроотрицательного атома. Разумеется, чем больше разница в электроотрицателностях атомов (силах спортсменов), тем сильнее от центра будет смещена электронная пара (канат). Заряды, которые приобретают атомы при полярной ковалентной связи, называются эффективными и обозначаются буквой δ. Они обозначаются верхним правым индексом. Например, молекула HCl образована двумя атомами, с относительными электроотрицательностями 2,1 (H) и 3,0 (Cl). Хлор, стягивая на себя общую электронную пару, приобретает отрицательный заряд, а водород, потерявший общую электронную пару, приобретает положительный заряд: H·+·Cl®H+δ –Cl-δ И чем больше разница в электроотрицательностях атома, тем больше по величине эти заряды. Однако, молекула по-прежнему является электронейтральной – сумма всех эффективных зарядов равна 0. Количественной мерой полярности связи служит электрический момент диполя (μ), равный произведению эффективного заряда δ на длину диполя l: μ= δ × l. Полярность связи не следует путать с поляризуемостью. Поляризуемость – это способность становиться полярной (или более полярной) в результате действия на молекулу внешнего электрического поля. От поляризуемости связи зависит то, как химическая связь распадается в процессе химических реакций. Если связь в данных условиях поляризуется, то происходит гетеролитический разрыв химической связи – в результате такого разрыва общая электронная полностью смещается к электроотрицательному атому, и он становится отрицательно заряженным ионом - анионом: H:Cl®H++:Cl- Атом, лишившийся общей пары, становится положительно заряженным ионом – катионом. В результате этой реакции образовался катион водорода (H+) и анион хлора (Cl-). Так происходит разрыв связи в процессе электролитической диссоциации в воде. Если связь данных условиях не поляризуется, то происходит гомолитический разрыв связи – общая электронная пара распадается, оставляя каждому атому по электрону. В результате образуются частицы с неспаренными электронами – радикалы: H:Cl®H·+·Cl Таким образом молекула HCl распадется при нагревании. Подытожим. Химическая связь является результатом сложных электронно-протонных взаимодействий. Количественно химическую связь можно охарактеризовать с помощью её длины, энергии и валентного угла. В рамках МВС образование ковалентной связи происходит в результате перекрывания электронных облаков и формированием общей электронной пары. Образование ковалентной связи возможно по двум механизмам: обменному и дононо-акцепторному. Ковалентная связь обладает рядом характерных свойств: насыщаемостью, направленностью полярностью и поляризуемостью. Вопросы для самоконтроля 1) Что такое химическая связь? 2) С помощью каких методов можно описать химическую связь, и в чем их различие? 3) Как описывается образование ковалентной связи в рамках МВС? 4) Каким образом может происходить перекрывание электронных облаков? 5) Какими свойствами обладает ковалентная связь? Есть – ли разница между связями, образованными по донорно-акцепторному механизму и обменному? 6) Почему молекула воды не может иметь химический состав HO? 7) Из связей какого типа состоит химическая связь, обозначаемая тройным валентным штрихом? 8) Пользуясь таблицей относительных электроотрицательностей определите тип ковалентной связи в молекуле фосфина (PH3).
3.2 Гибридизация электронных облаков. Форма молекул.
Вернемся к примеру образования катиона аммония (NH4+). Выше был описан тот факт, что в катионе аммония все связи являются одинаковыми. Положительный заряд равномерно распределен между ними. В данном случае, между связями, образованными по обменному механизму, и связью, образованной по донорно-акцепторному, нет разницы. Но ведь одна из них образована за счет s-облака, а остальные три за счет p-облаков. Возможно, все дело в донорно-акцепторном механизме, который изменяет полученные химические связи?
Возьмем похожую молекулу, связи в которой так – же образованы центральным атомом с атомами водорода за счет одного s и трёх p-облаков, но исключительно по обменному механизму – молекулу метана (CH4): 6C* 1s2 1H 1s1
Если измерить длину связей и их энергию, то окажется, что в молекуле метана они тоже равноценны. Казалось – бы, связи образованы за счет разных электронных облаков 2s и трёх 2p, с разной энергией и формой, значит, и связи должны отличаться друг от друга. Но нет. Для объяснения этого явления была создана модель гибридизации электронных облаков. Идея этой модели заключается в понятии гибридизации – выравнивании по форме и энергии электронных облаков с образованием новых, одинаковых по форме и энергии. Новые облака называются гибридными, их число равно сумме электронных облаков, участвующих в гибридизации. Основные положения этой модели таковы: Если у атома, вступающего в химическую связь, имеются электронные облака различной формы, то в процессе образования химической связи происходит гибридизация этих облаков. Новые облака называются гибридными, их число равно сумме исходных облаков, участвующих в гибридизации. Здесь необходимо отметить, что модель гибридизации, основанная на модели электронного облака, является лишь нашим представлением о неизвестных реальных процессах. Эта модель является удобным инструментом, с помощью которого можно объяснить некоторые особенности образования химической связи. Если будет создан другой, более совершенный инструмент, то от модели гибридизации откажутся. 2. Форма гибридного облака отличается от формы исходного. В гибридном облаке электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с электронным облаком другого атома происходит максимальное перекрывание, которое приводит к повышению энергии связи. Ниже на рисунке 3.8 представлены два примера формы гибридных облаков:
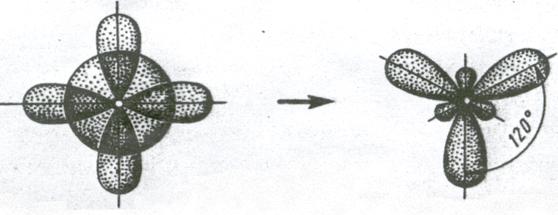
Рисунок 3.8. Формы гибридных облаков. Слева на этом рисунке представлена форма гибридного облака, которое получилось в результате гибридизации s и p облаков, справа форма гибридного облака, образованного из p и d облаков. Как видно из этих рисунков, при образовании σ-связей гибридные облака, из-за асимметричного строения, смогут образовать более полное перекрывание, чем в случае перекрывания двух негибридных облаков. Тип гибридизации определяется тем, какие исходные облака в неё вступают: 1) sp-гибридизация. В данном случае в гибридизацию вступают одно s и одно p облако. В результате получается два гибридных, которые равноценны друг – другу. Это значит, что в пространстве имеются две зоны с электронами, которые отталкиваются друг от друга. Впрочем, в случае из двух точек все просто, как бы их не расположить – все равно получится линия, валентный угол будет равен 1800 (рисунок 3.9):
Рисунок 3.9. sp-гибридизация. 2) sp2- гибридизация. В данном случае в гибридизацию вступают одно s и два p-облака. В результате получается три гибридных. Так как они равноценны друг другу, то формируют правильный треугольник, с валентным углом 1200 (рисунок 3.10):
Рисунок 3.10. sp2- гибридизация. 3) sp3- гибридизация. В данном случае в гибридизацию вступают одно s и три p-облака. В результате получается четыре гибридных, которые одинаково взаимодействуют друг с другом. Поэтому они образуют… нет, не квадрат. Речь идет не о плоскости, а о пространстве, поэтому они образуют правильный тетраэдр с валентным углом 109028’(рисунок 3.11):
Рисунок 3.11. sp3- гибридизация. Это основные типы гибридизации, но помимо s и p облаков возможно вступление d и f-облаков в гибридизацию. 4) sp3d- гибридизация. Вступает в гибридизацию пять облаков: одно s, три p и еще одно d. Пять точек в пространстве располагаются в виде т.н. тригональной бипирамиды (рисунок 3.12).
Рисунок 3.12. Размещение атомов в случае sp3d (слева) и sp3d2-гибридизации (справа). 5) sp3d2- гибридизация. Вступает в гибридизацию шесть облаков: одно s, три p и еще два d. Шесть точек в пространстве располагаются в виде тетрагональной бипирамиды (октаэдра) (рисунок 3.12). Как видно из рисунков 3.9-3.12 форма молекулы определяется типом гибридизации центрального атома. В качестве примера определим форму молекулы метана (CH4). Атом углерода в молекуле метана находится в возбужденном состоянии, у него на 2s и 2p подуровнях находится четыре неспареных электрона: 6C* 1s2 Эти облака вступают в гибридизацию. Одно s-облако и три p-облака, очевидно, гибридизуются по типу sp3. Все атомы, которые образуют связь с гибридными облаками углерода одинаковы, это атома водорода: 1H 1s1 Поэтому молекула будет симметричной. Тип гибридизации центрального атома определяет форму молекулы. Четыре гибридных облака – четыре вершины для фигуры в пространстве – тетраэдрическая молекула (рисунок 3.13):
Рисунок 3.13. Электронные облака молекулы метана. Валентный угол совпадает с углом правильного тетраэдра - 109028’. Но помимо тех облаков, которые непосредственно вступают в процесс формирования химической связи, на форму молекулы оказывают влияние и те облака валентного уровня, на которых остались электронные пары. Вернемся к молекуле аммиака (NH3). У центрального атома азота помимо трёх неспареных электронов на 2p-подуровне имеется еще и электронная пара на подуровне 2s: 7N 1s2 И облако с этой парой электронов тоже вступает в процесс гибридизации. Поэтому, в молекуле аммиака тип гибридизации центрального атома аналогичен типу гибридизации атома углерода из предыдущего примера. Три p-облака, содержащие неспаренные электроны, и s-облако с парой электронов гибридизуются по типу sp3. Однако, в этот раз молекула не будет симметричной. Ведь пара электронов азота не тратится на образование химической связи с атомами водорода. Поэтому, интенсивность взаимодействия этой пары со своими соседями – химическими связями будет отличаться от взаимодействия между этими связями. То есть, одна из вершин в тетраэдре становится неравноценной остальным, поэтому форма тетраэдра будет искажаться. Валентный угол в молекуле аммиака близок к углу правильного тетраэдра, но не равен ему. Он составляет примерно 1070[28]. Электронные облака в молекуле аммиака располагаются следующим образом (рисунок 3.14):
Рисунок 3.14. Электронные облака молекулы аммиака. Итак, форма молекулы определяется типом гибридизации. Гибридизация – это выравнивание электронных облаков по форме и энергии. Процесс гибридизации выгоден атому, так как новая форма гибридного облака позволяет образовывать более полное перекрывание, и следовательно, энергия образованной такими облаками химической связи будет больше. В гибридизацию вступают облака валентных уровней, которые содержат неспаренные электроны, непосредственно участвующие в химической реакции, а так – же облака с парами электронов.
Пример решения задачи на определение формы молекулы. Задание: определить форму молекулы воды (H2O). Решение: Электронная конфигурация центрального атома - кислорода 1s2 2s2 2p4 8O 1s2 Электронная конфигурация атома водорода 1s1 1H 1s1 У центрального атома имеется 2 пары электронов на 2s и 2p орбиталях и два валентных электрона на двух 2p орбиталях. Отсюда, тип гибридизации атома кислорода sp3. У атома водорода имеется всего лишь одно электронное облако, тут нечему вступать в гибридизацию. Значит, исходной фигурой для поиска формы молекулы является тетраэдр, и валентный угол должен быть близок к тетраэдрическому. Так как две орбитали заняты парами электронов, то молекула воды имеет угловое строение:
Ответ: так как центральный атом находится в состоянии sp3-гибридизации, и на двух гибридных облаках размещаются электронные пары, то молекула воды имеет угловое строение, валентный угол близок к тетраэдрическому.
Вопросы для самоконтроля 1. Что такое гибридизации? 2. Какие облака вступают в гибридизацию? 3. Каковы основные типы гибридизации? 4. Как гибридизация центрального атома влияет на форму молекулы?
Задачи для самоконтроля 1. Определить форму молекулы фосфина PH3. Ответ: искаженный тетраэдр. 2. Определить форму молекулы хлорида бериллия BeCl2. Ответ: линейная. 3. Определить форму молекулы хлорида бора BCl3. Ответ: правильный треугольник.
3.3 Ионная и металлическая связи.
В начале третьей главы упоминалось о том, что химические связи, в зависимости от распределения в них электронов, обладают разными свойствами. В связи с этим, помимо рассмотренной выше, ковалентной связи, выделяют еще ионные, металлические и межмолекулярные. Ионная связь – это связь, которая осуществляется в результате образования и электростатического взаимодействия противоположно заряженных ионов. Ионная связь образуется в том случае, если атомы, образующие химическую связь обладают сильно различающейся электроотрицательностью. Тогда общая электронная пара настолько сильно смещается к более электроотрицательному атому, что он превращается в заряженную частицу – анион, которая удерживает вокруг себя положительные частицы – катионы не столько за счет общей электронной пары, сколько за счет кулоновских сил электростатического притяжения. Из-за того, что частицы, образовавшие ионную связь, превращаются в точечные заряды, свойства ионной связи сильно отличаются от свойств ковалентной связи. Ионная связь, в противовес ковалентной, обладает свойствами ненасыщенности и ненаправленности. Частицы удерживаются вместе взаимным притяжением электрических полей. И такое поле, в отличие от электронного облака, во-первых, имеет сферическую форму, а во-вторых, не компенсируется полностью соседними полями. Поэтому количество непосредственных соседей у иона может варьироваться. Это и есть свойство ненасыщаемости. Если количество соседей у атома, создавшего ковалентную связь, определяется его валентностью, и существует правило насыщаемости, обязывающее атом тратить все свой неспаренные электроны, то у ионов таких ограничений нет. Ненаправленность тоже вытекает из свойств электрического поля иона. Это поле имеет сферическую форму. Сфера равноценна во всех направлениях, поэтому не имеет значения, с какой стороны произойдет его компенсация. В веществах с ионной химической связью нет какого-то приоритетного направления, в отличие от направленных ковалентных связей. Каждый ион окружен ионами противоположного знака, причем из-за отсутствия у ионной связи направленности и насыщаемости, количество и расположение соседних противоионов различается. Поэтому вещество с ионной связью является кристаллом, который можно представить как единую гигантскую молекулу (рисунок 3.15):
Рисунок 3.15. Модель кристалла хлорида натрия. Забегая чуть дальше нужно отметить, что для вещества с ионной связью использование химической формулы не всегда является корректным. Так как кристалл состоит из громадного числа частиц, которые не связаны ковалентными связями, то соотношение числовых коэффцициентов в химической формуле очень велико NanClm, и так как в кристалле всегда присутствуют дефекты структуры, m и n еще и не соответствуют валентному соотношению. Кроме того, несмотря на столь большие различия между свойствами ковалентной связи и ионной провести между ними границу не всегда возможно. Полного смещения электронной пары не происходит даже в случае максимально возможной электроотрицательнти между атомами (щелочной мета и галоген). Условно считается, что граница между ковалентной поляной и ионной связью лежит на значении эффективного заряда в 0,5 от заряда электрона. Если эффективный заряд при атомах ковалентной полярной связи более половины заряда электрона, то связь считается ионной. Металлическая связь возникает в том случае, если при формировании кристалла участвуют элементы, которые легко отдают свои электроны. В результате связь формируется за счет обобществления всех валентных электронов в кристалле, а не пары электронов между двумя атомами, как при формировании обычной ковалентной связи. То есть, металлическая связь является нелокализованной, она не является собственностью пары атомов. Свойством отдавать свои электроны обладают металлы, поэтому связь характерна для этого класса веществ, и называется соответственно. Так как электронов в металлическом кристалле много, то они формируют так называемый «электронный газ», поэтому кристалл металла можно рассматривать как набор катионов металла, которые погружены в электронный газ. Из-за принципиально различной природы физические свойства кристаллов с ионной и металлической связью сильно отличаются: · Электронный газ находится на гигантском электронном облаке, поэтому электроны могут легко путешествовать по такому кристаллу. Вещества с металлической связью являются хорошими проводниками электрического тока. · По этой – же причине металлы обладают своей прочностью, ковкостью и пластичностью. Наглядный пример притчи, в которой мудрец просит переломить богатыря сначала один прутик, а потом их связку. · Характерный металлический блеск обусловлен отражением света электронным газом, который выходит за пределы кристаллической решетки.
Вопросы для самоконтроля
1. Что такое ионная связь? В каких случаях она формируется? 2. Какими свойствами обладает ионная связь? 3. Что такое металлическая связь? 4. Что такое электронный газ? Какие свойства он придает металлической связи?
Глава 4. Химические формулы, уравнения и количественные расчеты.
Сформировав представление о том, как формируется химическая связь, что такое валентность, как обозначаются атомы различных химических элементов, можно приступить к изучению правил составления химических формул и их использовании в химических уравнениях. Для начала вернемся к закону Дальтона: если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа. Джон Дальтон на основе экспериментальных данных создал первый эталон массы атома т.н. «соединительный вес». Соединительный вес – это масса данного элемента, который вступает в реакцию с 1 граммом водорода. Если элемент с водородом не образует соединений, то тогда его соединительный вес высчитывается как массу этого элемента, соединяющуюся с 8 граммами кислорода. Например: Ø 1 грамм водорода соединяется с 8 граммами кислорода Ø 1 грамм соединяется с 25 граммами мышьяка Ø 1 грамм водорода соединяется с 3 граммами углерода Отсюда следует, что при реакции углерода и кислорода их массы должны относиться друг к другу как их соединительные веса 3 к 8. И действительно, если высчитать соотношение масс в углекислом газе (27,27% и 72,73%), то их отношение будет равным 3 к 8. Эти соотношения впервые отметил Иеремия Вениамин Рихтер между 1792 и 1802 г [29]. На его открытие не обратили внимания, из-за серьезного недостатка предложенной схемы – у нескольких элементов существует несколько соединительных весов, а кроме того, некоторые, вытекающие из этих заключений соединения не существуют. Так, например соединительный вес серы равен 8, соединительный вес кислорода тоже 8. Следовательно, массы серы и кислорода должны относиться в их соединении как 1 к 1, но это не единственный оксид серы (SO2). Существует еще один оксид (SO3), в котором соединительный вес серы 5 Итак, поскольку соединительные весы различных элементов соотносятся как небольшие целые числа, логично предположить, что в химических превращениях участвуют некие неделимые частицы, которые соединяются друг с другом в том – же соотношении, как простые целые числа. Причем, эти неделимые частицы обладают одинаковыми свойствами и массой (вот оно, определение атома). А раз так, то почему – бы не присвоить этим частицам условные обозначения и указывать их количество в формуле, тем самым отражая химический состав молекулы? Впервые это было продемонстрировано Дальтоном (рисунок 4.1):
Рисунок 4.1. Символическая запись Дальтона. Под его символами указано современное обозначение атомов. Однако так как атомы одного элемента способны присоединять к себе разное количество атомов другого элемента, то из-за этого их атомный вес непостоянен. Поэтому придётся ввести понятие валентности – это характеристика атома, отражающее кратность его атомных весов, то есть, его способность присоединять к себе разное количество атомов других элементов (это определение валентности, на которое опираются школьные учебники [1-6, 14, 15]: масса атома = валентность × соединительный вес Именно так были сформированы первые стехиометрические соотношения. Стехиометрия – это система законов, правил и терминов, обосновывающих расчёты состава веществ и количественных соотношений между массами (объёмами для газов) веществ в химических реакциях. Современные химические формулы похожи на символическую запись Дальтона – это символьная запись атомного состава, только элементы обозначаются латинскими символами из их названия: NaOH – гидроксид натрия, C2H2 – ацетилен, PH3 – фосфин. Нижний индекс после символа атома указывает на количество атомов данного элемента в молекуле. Если атом один, то единица опускается. Таким образом, в молекуле NaOH по одному атому натрия (Na), кислорода (O) и водорода. В молекуле ацетилена по 2 атома углерода (С) и водорода (H). В молекуле фосфина один атом фосфора (P) и 3 атома водорода (H). Определенное значение, при записи химической формулы имеет и порядок перечисления атомов элементов. Для отражения строения молекулы они могут группироваться. Так в сульфате алюминия 2 атома алюминия (Al), 3 атома серы (S) и 12 атомов кислорода, но исходя из записи, которая отражает только количество атомов в молекуле, нелегко догадаться, что речь идет именно об этом веществе Al2S3O12. Гораздо удобнее сгруппировать атомы, которые входят в состав катионов и анионов с помощью скобок: Al2(SO4)3. Из этой записи уже понятно, что 2 катиона алюминия (Al) связаны с 3 сульфат-анионами (SO4), каждый из которых состоит из одного атома серы (S) и 4 атомов кислорода (O). Химическую формулу можно вывести, зная валентность атомов химических элементов. Алгоритм следующий: 1) Описать электронную структуру атомов и определить количество неспареных электронов – валентность. 2) Определить наименьшее обще кратное между валентностями атомов (НОК). Согласно свойству насыщаемости атом обязан отдать все неспаренные электроны, таким образом, НОК – это количество химических связей в молекуле. 3) Поделить НОК на валентность. Полученный результат равен количеству атомов в молекуле. Логика тут простая, раз число связей в молекуле равно НОК, а валентность – это количество химических связей, то потребуется: «количество атомов» = «количество связей»/«валентность» 4) Выставить получившееся количество атомов в химическую формулу нижним индексом. В качестве примера рассмотрим оксиды углерода. В первом случае углерод находится в невозбужденном состоянии: |
|||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 350. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |





 A®D:A
A®D:A 2s2
2s2  2p3
2p3 

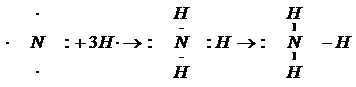

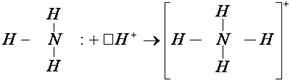
 2s2
2s2  2p3
2p3 




 3p4
3p4 



 2p6
2p6 
















 . С азотом еще интереснее – в аммиаке его соединительный вес 4
. С азотом еще интереснее – в аммиаке его соединительный вес 4  , и а в известных на тот момент трёх оксидах 3
, и а в известных на тот момент трёх оксидах 3  , 7 и 14! Однако, эти соединительные весы действительно относятся друг к другу в простых целочисленных отношениях. Атомные весы азота в аммиаке (NH3), и оксидах азота (NO2, NO, N2O) относятся друг к другу как
, 7 и 14! Однако, эти соединительные весы действительно относятся друг к другу в простых целочисленных отношениях. Атомные весы азота в аммиаке (NH3), и оксидах азота (NO2, NO, N2O) относятся друг к другу как  или как 4:3:6:12. Собственно, именно этот факт и отображен в еще одной формулировке закона Дальтона – если у элемента имеется несколько соединительных весов, то они относятся между собой как целые числа.
или как 4:3:6:12. Собственно, именно этот факт и отображен в еще одной формулировке закона Дальтона – если у элемента имеется несколько соединительных весов, то они относятся между собой как целые числа. 
