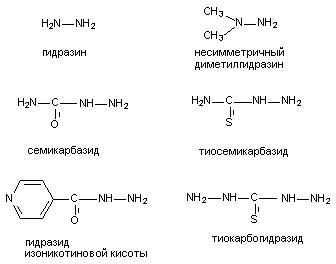Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
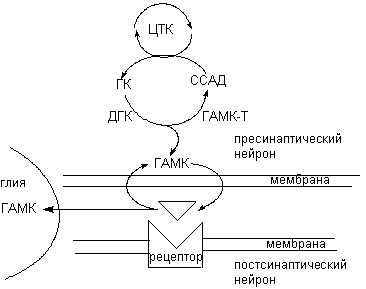
Конвульсанты, действующие на ГАМК-ергический синапс.Существуют многочисленные данные, подтверждающие участие ГАМК в механизмах пресинаптического и, резистентного к глицину, постсинаптического торможения. ГАМК - нейромедиатор в тормозных синапсах, как позвоночных, так и беспозвоночных животных. ГАМК вызывает гиперполяризацию возбудимой мембраны, что сопровождается формированием ингибиторного пстсинаптического потенциала (ИПСП). Установлено, что в основе этого действия лежит усиление проницаемости возбудимых мембран для ионов хлора. ГАМК обнаружена во всех структурах ЦНС. Концентрация аминокислоты в разных областях мозга колеблется в пределах от 2 до 10 мкМ/г ткани. Наивысшее её содержание - в чёрной субстанции. Высокая плотность ГАМК-ергических синапсов, выявлена в клиновидном ядре, ядре Дейтерса, на телах спинальных интернейронов, в обонятельных бугорках, коре головного мозга, коре мозжечка, гиппокампе, продолговатом мозге (нейронах ретикулярной формации), латеральных коленчатых телах, гипоталамусе, ядрах дорзальных рогов спинного мозга. Нейроны этих образований высоко чувствительны к ГАМК. В нервных окончаниях ГАМК обнаруживается главным образом в цитоплазме в несвязанной форме (60 - 80%); относительно небольшое количество вещества находится в пресинаптических везикулах. ГАМК образуется из глютамата под влиянием пиридоксальфосфат-зависимого энзима глютаматдекарбоксилазы (ДГК) (рисунок 6). ДГК - цитоплазматический энзим, широко представленный в структурах мозга, содержащих ГАМК в высокой концентрации. Источником глютамата является цикл Кребса. Катаболизм нейромедиатора осуществляется митохондриальным энзимом - трансаминазой ГАМК (ГМАК-Т). Он превращает вещество в сукцинатсемиальдегид, который, в свою очередь, окисляется другим митохондриальным энзимом, дегидрогеназой сукцинатсемиальдегида, с образованием янтарной кислоты. Последняя утилизируется циклом Кребса. 
Рисунок 6. Схема обмена ГАМК в ЦНС: ЦТК - цикл трикарбоновых кислот; ГК - глутаминовая кислота; ДГК - декарбоксилаза глутаминовой кислоты; ГМАК-Т - трансаминаза ГАМК; ССАД - сукцинатсемиальдегид Большая часть выделившейся в синатическую щель ГАМК удаляется путем высоко афинного, Na-зависимого активного обратного захвата, как нервными окончаниями, так и клетками глии. До 50% ГАМК ЦНС определяется в глиальных элементах мозга. Конвульсанты, действующие на ГАМК-ергический синапс, либо блокируют синтез и высвобождение ГАМК в синаптическую щель (аллилглдицин, 3-меркаптопропионовая кислота, антагонисты пиридоксальфосфата) либо являются её физиологическими антагонистами. 4.1.1.2.1.1. Антагонисты ГАМК Структура и физиология ГАМК-рецепторов окончательно не изучены. Не существует и их единой классификации. Наиболее распространено разделение рецепторов на ГАМКА и ГАМКБ типы по их чувствительности к бикукуллину. Наиболее изучены ГАМКА рецепторы, действию на которые и приписывают основные эффекты, вызываемые тормозным нейромедиатором. С ГАМКА-рецепторами связывается большое количество химических веществ, как облегчающих, так и блокирующих поступление ионов хлора через возбудимую мембрану (рисунок 7). Эти вещества являются соответственно агонистами или антагонистами ГАМК.
Рисунок 7. Схема строения ГАМК-рецептора, с указанием сайтов связывания ГАМК-ергических биологически активных веществ Бикукуллин Бикукуллин - алкалоид, выделяемый из растения Dicentra cucullaria. Его структура представлена на рисунке 8.
Рисунок 8. Структура молекулы бикукуллина В настоящее время вещество широко используется в практике экспериментальных исследований. Судорожный синдром развивается при подкожном введении крысам в дозе 5 мг/кг. Токсикокинетика соединения не изучена. Проявления судорожного синдрома похожи на судороги вызываемые пикротоксином. По существующим представлениям бикукуллин является селективным антагонистом ГАМК в структурах спинного мозга, ствола мозга и мозжечке и не вмешивается в проведение нервного импульса в глицинергических синапсах. Чувствительность различных ГАМК-рецепторов корковых нейронов к токсиканту неодинакова (на этом признаке построена их классификация на ГАМКА- и ГАМКБ-рецепторы). Полагают, что судороги, развивающиеся при отравлении бикукуллином, имеют субкортикальное происхождение и обусловлены гиперактивацией клеток Пуркинье мозжечка, а также нейронов клиновидного ядра, ствола мозга, спинальных нейронов, гиппокампа, латеральных коленчатых тел, гипоталамуса, ретикулярной формации. Бикукуллин препятствует связыванию ГАМК синаптосомами, содержащими ГМАК-рецепторы, что указывает на его способность действовать на сайт для ГАМК. В судорожных дозах вещество не влияет на активность ГАМК-трансаминазы и ДГК, а также на уровень ГАМК в структурах мозга. Этосуксимид и вальпроевая кислота практически не препятствуют развитию судорог, вызываемых бикукуллином. Судорожные барбитураты Судорожные барбитураты представляют большой интерес, поскольку являются антагонистами свих аналогов - барбитуратов, усиливающих тормозные процессы в ЦНС (гексенал, барбитал и др.). Структура таких соединений представлена на рисунке 9. ЦГБК синтезирована и впервые изучена Vellus et al. в 1951 году, ДМБК - Swanson и Chen в тридцатые годы.
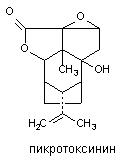
Рисунок 9. Структура молекул судорожных барбитуратов Токсикокинетические характеристики веществ такие же, как и у других производных барбитуровой кислоты. Клонико-тонические судороги у мышей ЦГБК при внутривенном введении вызывает в дозах 3 - 9 мг/кг, ДМБК - около 3 мг/кг. Судорожное действие веществ подавляется пентабарбиталом. Такие противосудорожные средства как фенитоин, триметадоин, мефенезин не предотвращают развитие эффекта. Механизм действия веществ не изучен. По всей видимости, они действуют на сайт связывания барбитуратов, выступая в качестве антагонистов ГАМК. При этом каким-то образом изменяется проницаемость возбудимой мембраны для ионов кальция, поскольку токсиканты не оказывают действия на реактивные структуры (препарат аорты кролика) в инкубационной среде, не содержащей Са2+. Пикротоксин Пикротоксин выделяют из Anamerta cocculus - кустарника, произрастающего в Восточной Индии. Исходный экстракт содержит два дилактона: пикротин, практически инертное вещество, и пикротоксинин активный конвульсант, структура которого представлена на рисунке 10.
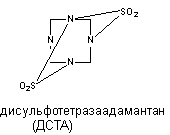
Рисунок 10. Структура молекулы пикротоксинина Токсикокинетика вещества изучена недостаточно. Оно быстро абсорбируется при всех способах аппликации, однако судороги развиваются по прошествии определенного скрытого периода. Возможно, в этот период происходит биотрансформация вещества, его взаимодействие с ДГК или другие явления. Однако не исключено, что скрытый период - следствие медленного преодоления веществом гематоэнцэфалического барьера. Особенности распределения вещества и пути его биотрансформации неизвестны. Судя по кратковременности действия, процесс элиминации происходит с большой скоростью. Пикротоксин вызывает клонические судороги. При увеличении дозы преобладает тонический компонент, причем тоническое сокращение сгибателей предшествует сокращению разгибателей. На фоне двигательных нарушений появляются вегетативные реакции: саливация, иногда рвота, повышение артериального давления. Предсудорожные дозы вещества стимулируют дыхание. Пикротоксин возбуждает все отделы ЦНС, однако у спинальных животных судорожный синдром вызывается более высокими дозами яда. В опытах на животных установлено, что пикротоксин блокирует как пресинаптическое, так и резистентное к стрихнину постсинаптическое торможение в ЦНС. Известно, что стрихнин не влияет на тормозные процессы, реализуемые через ГАМК. Ни стрихнин, ни пикротоксин, применённые в отдельности не вызывают полной активации мотонейронов спинного мозга. Совместное действие стрихнина и пикротоксина приводит к полному блоку механизма торможения мотонейронов и их перевозбуждению. Таким образом, по крайней мере, половина тормозных синапсов мотонейронов ГАМК-эргичны. ГАМК-эргические механизмы пресинаптического торможения представлены в структурах, ответственных за обработку сенсорной информации: дорзальных рогах спинного мозга, клиновидном и нежном ядрах продолглватого мозга, латеральных коленчптых телах, хвостатом ядре, талямусе. Блокадой мехенизмов торможения в сенсорных структурах можно объяснить своеобразный эффект, наблюдаемый у отравленных - появление генерализованных судорог при стимуляции сенсорных систем. Поскольку ни ГАМК, ни её агонист мусцимол не влияют на связывание пикротоксина с ГАМК-рецептором, вероятно, токсикант не взаимодействует с сайтом, связывающим ГАМК. Существуют данные о прямом действии пикротоксина на возбудимые нейрональные мембран. При этом вещество угнетает прохождение ионов хлора через ионный канал. Пикротоксин практически не влияет на энзимы синтеза и разрушения ГАМК, хотя в некоторых исследования зарегистрировано подавление синтеза нейромедиатора в мозге отравленных лабораторных животных. Тетраметилендисульфотетрамин (дисульфотетразаадаматнтан, ДСТА). ДСТА - смолоподобное вещество, которое первоначально, до обнаружения его высокой токсичности, использовали в мебельной промышленности для обработки древесины. Структура соединения представлена на рисунке 11.
Рисунок 11. Структура молекулы дисульфотетразаадамантана Средняя смертельная доза токсиканта для грызунов составляет 0,2 - 0,4 мг/кг. ДСТА является неконкурентным и обратимым антагонистом ГАМК. При системном введении экспериментальным животным ДСТА чувствительность части нейронов ствола головного мозга и клиновидного ядра к ГАМК и глицину существенно снижается. Поскольку вещество не влияет на характер связывания с рецептором ГАМК, бикукуллина и пикротоксин, полагают, что ДСТА действует через собственный сайт, вероятно ионофорный канал. Бициклические фосфорорганические соединения (БЦФ) В 1973 году Bellet и Casida исследовали группу бициклических фосфорорганических соединений, не обладающих антихолинэстеразной активностью, но вызывающих приступ судорог и гибель экспериментальных животных при введении в малых дозах. Структура БЦФ представлена на рисунке 12. Биологически активные вещества такого строения относятся к бициклофосфатам, бициклофосфоротионатам и бициклофосфитам.
Рисунок 12. Структура молекул бициклических фосфорорганических соединений Все они твердые вещества, плохо растворимые в воде. Могут оказывать токсическое действие при подкожном, внутримышечном, внутривенном, а некоторые представители, и при ингаляционном способе введения (в форме аэрозоля). Токсичность веществ существенно зависит от строения радикала R и может быть очень высокой для отдельных соединений. Так, ЛД50 третбутилбициклофосфата для грызунов составляет около 50 мкг/кг массы. Проявления судорожного синдрома одинаковы при действии всех токсикантов и характеризуются быстрым развитием приступов клонических судорог, постепенно перерастающих в клонико-тонические. Токсикокинетика веществ не изучена. Считается, что БЦФ - неконкурентные антагонисты ГАМК. Их токсичность обусловлена блокадой хлор-ионных ГАМК-рецепторов. Близкие по структуре соединения бициклоортокарбоксилаты и бициклоортобензоаты (рисунок 13) также способны связываться с хлор-ионофорным сайтом ГАМК-рецептора и вызывать судороги.
Рисунок 13. Структура молекул триоксибициклокарбоксилатов Токсичность веществ зависит от строения радикалов R1 и R2 и для некоторых представителей, при внутрибрюшинном способе введения, ЛД50 составляет около 1 мг/кг массы экспериментального животного (4-третбутил-1(3,4-дихлофенил)-бициклоортобензоат). Норборнан 2,2-ди(трифторметил)-3,3-дициано-5,6-дихлорнорборнан (норборнан) - один из самых токсичных синтетических конвульсантов. Вещество синтезировано в начале 80-х годов Мидлтоном (США). Структура вещества представлена на рисунке 14.
Рисунок 14. Структура молекулы 2,2-ди-(трифторметил)-3,3-дициано-5,6-дихлорнорборнана Кристаллическое вещество, растворимое в воде, оказывает эффект при всех способах введения. Видовая чувствительность к норборнану выражена слабо и составляет в среднем 0,07 - 0,2 мг/кг. Токсикокинетика вещества не изучена. Интоксикация характеризуется растянутой во времени клиникой поражения, что отличает её от клиники поражения лабораторных животных другими ГАМК-литиками. Так, при подкожном введении крысам смертельной дозы норборнана, скрытый период составляет около 1,5 часов, судорожный - до 4 часов, продолжительность жизни отравленных животных - более 6 часов (для сравнения, аналогичные токсикодинамические характеристики пикротоксина составляют, соответственно: 0,5 часа; 0,5 часа и 1 час). Судорожный период характеризуется волнообразным течением. Приступы клонико-тонических судорог сменяются периодами ремиссии. Сенсорная стимуляция провоцирует формирование ризуса. По существующим представлениям норборнан - избирательный блокатор хлор-ионофоров ГАМКА-рецепторов. Фенобарбитал препятствует развитию судорог, вызываемых норборнаном. Производные бензодиазепина - малоэффективны. 4.1.1.2.1.2. Ингибиторы синтеза ГАМК К числу веществ, угнетающих синтез ГАМК, принадлежат, прежде всего, ингибиторы декарбоксилазы глутаминовой кислоты (ДГК), в частности: аллилглицин, 3-меркаптопропионовая кислота, кислород под повышенным давлением, соединения - антагонисты пиридоксальфосфата (коэнзим ДГК). Антагонисты пиридоксальфосфата, в силу широкого использования их в практике, представляют особый интерес. Структура некоторых из них представлена на рисунке 15. По большей части это производные гидразина.
Рисунок 15. Структура некоторых веществ - антагонистов пиридоксальфосфата При введении в дозах, близких к смертельным, вещества вызывают клонико-тонические судороги, приступы которых чередуются с периодами ремиссии. Судорогам предшествует скрытый период, продолжительностью около полутора часов. Наиболее токсичным, из представленных на рисунке, веществом является тиокарбогидразид, наименее токсичным - изониазид. ЛД50 несимметричного диметилгидразина для крыс при внутрибрюшинном введении составляет около 100 мг/кг. Фенобарбитал, триметадион, а также пиридоксин подавляют судороги, вызываемые производными гидразина, как у человека, так и у лабораторных животных. Фенитоин практически не эффективен. В основе токсического действия рассматриваемых веществ лежит способность взаимодействовать с пиридоксалем с образованием пиридоксальгидразонов, которые, являются ингибиторами энзима пиридоксалькиназы как in vitro, так и in vivo. Это, в сою очередь, приводит к нарушению синтеза в цитоплазме нейронов пиридоксальфосфата - коэнзима многих ферментов, среди которых ДГК и трансаминаза ГАМК (ГАМК-Т). Таким образом, гидразин и его производные угнетают не только синтез, но и разрушение ГАМК, однако действие на синтетический процесс выражено сильнее и потому содержание ГАМК в ткани мозга снижается. Обычно судороги развиваются при снижении активности ДГК на 40 и более процентов. Тем не менее, в условиях эксперимента не удается проследить четкую зависимость между выраженностью проявлений интоксикации и степенью снижения уровня ГАМК в мозге. Отчасти это связано с тем, что подавление синтеза нейромедиатора в пресинаптических структурах маскируется его накоплением в глиальных клетках вследствие угнетения инактивации ГАМК-Т. 4.1.1.2.1.3. Вещества, блокирующие высвобождения ГАМК из нервных окончаний С действием на пресинаптические ГАМК-эргические структуры связывают судорожную активность тетанотоксина. Тетанотоксин продуцируется анаэробными бактериями Clostridium tetani. Это белок, состоящий из двух субъединиц с молекулярной массой 100000 и 50000 дальтон. Неустойчив при нагревании. Летальная доза для грызунов - около 2* 10-6 мг/кг массы животного. Для людей смертельная одноразовая доза токсина составляет 0,2 - 0,3 мг. После действия токсина скрытый период может продолжаться в течение нескольких суток. Вслед за общими проявлениями недомогания развивается тризм жевательной мускулатуры, а затем и других групп мышц. Смерть наступает от остановки дыхания в результате тонического сокращения дыхательной мускулатуры. У млекопитающих токсин также вызывает приступы тонических судорог. Установлено, что при этом блокируется выброс тормозных нейромедиаторов ГАМК и глицина пресинаптическими структурами. При внутримышечном введении лабораторным животным, вещество с помощью механизма ретроградного аксонального тока по волокнам нервных стволов проникает в ЦНС. Имеются доказательства способности токсина к транссинаптической миграции. ГЭБ для тетанотоксина не проницаем. Механизм действия вещества изучен недостаточно. В ряде исследований показано наличие в нервных окончаниях специфических сайтов связывания токсина. Эти структуры представляют собой ганглиозиды или углеводные комплексы, близкие по строению ганглиозидам. Сиаловая кислота, как полагают, - важнейший компонент этих сайтов. Тетанотксин не связывается с ненейрональными клеточными мембранами и в этом одна из причин его высокой токсичности. Структурно рецептор тетанотоксина вероятно напоминает рецептор тиреотропина. Токсин способен связываться с препаратом мембран, приготовленных из ткани щитовидной железы, при этом тиреотропин блокирует это связывание. Вместе с тем in vivo гормон потенцирует связывание токсина мембранами нервных клеток. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 383. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |