
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Теория четырёх квантовых чисел. Их физический смысл.Теория Бора приписывала четырем электронным оболочкам К, L, М и N квантовое число n, равное соответственно 1, 2, 3 и 4. Эти числа соответствуют повышающимся энергетическим уровням оболочек. Однако внимательное рассмотрение атомных спектров показывает, что линии, обусловленные переходами между такими квантовыми энергетическими уровнями, на самом деле расщеплены на более тонкие линии. Это указывает, что электронные оболочки в действительности расщеплены на подоболочки, каждая со своим собственным квантовым энергетическим уровнем. Порядок заполнения уровней, подуровней. Правило Хунда, Паули. Валентность. Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах - раздел Химия, Общая химия Последовательность Заполнения Электронами Уровней, Подуровней, Орбиталей В Мн... Последовательность заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах определяют:1) принцип наименьшей энергии;2) правило Клечковского;3) принцип запрета Паули;4) правило Гунда. Принцип наименьшей энергии: максимуму устойчивости системы соответствует минимум её энергии. Следовательно, в соответствии с данным принципом электроны будут вначале располагаться на атомных орбиталях, имеющих минимальную энергию, в этом случае связь электронов с ядром наиболее прочная и атомная система находится в состоянии максимальной устойчивости многоэлектронных атомах электроны испытывают не только притяжение ядер, но и отталкивание электронов, находящихся ближе к ядру и экранирующих ядро от более далеко.расположенных электронов. Поэтому последовательность возрастания энергии орбиталей усложняет  При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частицы с полуцелым спином) не могут одновременно находиться в одном и том же квантовом состоянии. Принцип был сформулирован для электронов Вольфгангом Паули в 1925 г. в процессе работы над квантомеханической интерпретацией аномального эффекта Зеемана и в дальнейшем распространён на все частицы с полуцелым спином. Полное обобщённое доказательство принципа было сделано им в теореме Паули (теореме о связи спина со статистикой) в 1940 г. в рамках квантовой теории поля. Из этой теоремы следовало, что волновая функция системы фермионов является антисимметричной относительно их перестановок, поведение систем таких частиц описывается статистикой Ферми — Дирака. Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы, в данном квантовом состоянии, может находиться только один фермион, состояние другого должно отличаться хотя бы одним квантовым числом. Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 930. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

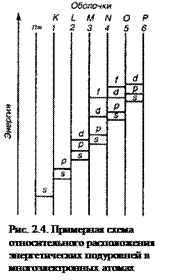 Правило Хунда — правило квантовой химии, определяющее порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Правило Хунда — правило квантовой химии, определяющее порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.