
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Реакция Селиванова (обнаружение кетоз)Стр 1 из 3Следующая ⇒ Лабораторная работа № 1 «Изучение свойств белков и аминокислот» Опыт №1. Биуретовая реакция
Биуретовая реакция – это реакция обнаружения пептидной связи в белках. Белки (пептиды) в щелочном растворе в присутствии солей меди(ΙΙ) образуют комплексные соединения, окрашенные в сине-фиолетовый или красно-фиолетовый (продукты неполного гидролиза белка) цвет. Реактивы:раствор яичного белка, 1 %; раствор NaOH, 10 %; раствор CuSO4, 1 %. К 1 мл раствора белка приливают 1 мл раствора NaOH и 1–2 капли раствора сульфата меди. Отмечают появление окраски.
Опыт №2. Обнаружение α-аминокарбоновых кислот Реактивы:раствор белка, 1 % (яичного и желатина); раствор NaOH, 10 %; раствор нингидрина, 0,5 %; раствор ацетата свинца, 5 %.
А(нингидриновая реакция). К 1 мл раствора белка (яичного и желатина) прибавляют 0,5 мл раствора нингидрина, нагревают на водяной бане (70 0С). Отмечают появление окраски. Б(реакция Фоля). К 1 мл раствора белка (яичного и желатина) добавляют 1 мл 10 %-го раствора щелочи и 3–4 капли 5 %-го раствора соли свинца. Смесь кипятят на водяной бане. Отмечают появление и цвет осадка.
Опыт №3. Обнаружение циклических аминокислот Реактивы:растворы белка, 1 % (яичного и желатина); азотная, серная и уксусная кислоты, концентрированные; раствор формальдегида, 3 %; раствор NaNO2 , 5 %; раствор сульфаниловой кислоты, 1 % в 5 %-ном растворе HCl; растворы NaOH и Na2CO3, 10 %. А(ксантопротеиновая реакция). В две пробирки вносят по 1 мл раствора белка (яичного и желатина), добавляют по 3 капли концентрированной азотной кислоты. Смесь осторожно нагревают до появления желтой окраски. После охлаждения осторожно добавляют 10 капель раствора щелочи. Отмечают изменение окраски.  Б(реакция Адамкевича на триптофан). К 1 мл раствора яичного белка прибавляют 1 мл концентрированной уксусной кислоты и осторожно нагревают до растворения осадка. После охлаждения к смеси осторожно добавляют 1 мл концентрированной серной кислоты (по каплям по стенке пробирки, чтобы жидкости не смешались). Через 5–10 мин на границе раздела слоев отмечают появление окрашенного кольца. В(реакция Вуазене на триптофан). К 2 мл раствора яичного белка добавляют 1 каплю раствора формальдегида. К полученной смеси, тщательно перемешивая, добавляют осторожно по каплям 6 мл концентрированной серной кислоты. Пробирку охлаждают в ванночке со льдом. Через 10 мин добавляют, перемешивая, 10 капель раствора нитрита натрия. Отмечают окрашивание. Г(реакция Паули на гистидин и тирозин). К 1 мл раствора сульфаниловой кислоты приливают 2 мл раствора нитрита натрия, перемешивают и добавляют 2 мл раствора яичного белка и после перемешивания 6 мл раствора карбоната натрия. Отмечают окрашивание раствора.
Опыт №4. Реакции осаждения белков
Многие факторы влияют на физико-химические свойства белков, вызывая изменение структуры макромолекул. Этот процесс называется денатурацией. При денатурации нарушается активная конформация белковой молекулы. Эти изменения касаются в первую очередь вторичной и третичной структуры без нарушения при этом ковалентных (пептидных) связей. Факторы, вызывающие денатурацию, можно разделить на две группы: физические и химические. К физическим относятся высокая температура, механические воздействия, обработка ультразвуком, действие ионизирующих излучений; к химическим – осаждение ионами тяжелых металлов, минеральными и органическими кислотами, нейтральными солями аммония, щелочных и щелочноземельных металлов; органическими растворителями, реактивами на алкалоиды. Аналогичное по результатам действие оказывают ПАВ, мочевина, некоторые красители. Реакции осаждения белков бывают обратимыми и необратимыми. При обратимом осаждении макромолекулы белка в основном не подвергаются глубокой денатурации, а осадки могут быть снова растворены в исходном растворителе (воде). Обратимое осаждение вызывается действием нейтральных солей аммония, щелочных и щелочноземельных металлов (высаливание), спирта, ацетона, эфира и некоторых других органических растворителей. При необратимом осаждении происходит глубокая денатурация белка, он теряет свою гидрофильность. Денатурированный белок неспособен к восстановлению своих первоначальных физико-химических и биологических свойств. Необратимое осаждение вызывается высокой температурой, действием концентрированных минеральных и некоторых органических кислот, ионов тяжелых металлов, ПАВ, красителей, реактивов на алкалоиды. А(осаждение белков солями щелочных и щелочноземельных металлов). Реактивы: раствор яичного белка; сернокислый аммоний, насыщенный раствор; сернокислый аммоний, тонко растертый порошок. В пробирку наливают 2-3 мл раствора белка, добавляют равный объем насыщенного раствора сернокислого аммония и перемешивают. Выпадает осадок глобулинов, альбумины должны остаться в растворе. Осадок отфильтровывают через бумажный фильтр. К фильтрату добавляют тонко растертый порошок до получения насыщенного раствора (последняя порция соли не растворяется). Выпавший осадок альбуминов отфильтровывают. С фильтратом проделывают биуретовую реакцию. При полном осаждении белков она должна быть отрицательной. Для доказательства обратимости высаливания к осадкам 1 и 2 на фильтрах добавляют по 2 мл дистиллированной воды и снова проводят биуретовую реакцию. Б(осаждение белков органическими растворителями). Органические растворители (спирт, ацетон, эфир и др.) вызывают дегидратацию белковых молекул, разрушая их гидрофильные оболочки, что ведет к понижению устойчивости белков в растворе и выпадению в осадок. Лучше всего происходит осаждение белков из нейтрального или слабокислого растворов, в щелочных растворах осаждение органическими растворителями затормаживается. Осаждению способствует также присутствие в растворе электролитов (например, хлористого натрия). Реактивы: раствор яичного белка; этанол (или ацетон); хлорид натрия. В пробирку наливают 1 мл раствора белка, добавляют на кончике шпателя порошка NaCl и взбалтывают до растворения. По каплям приливают 4 мл спирта, сильно взбалтывают. Через 5–10 мин выпадает осадок белка. Сразу после появления осадка отливают часть содержимого пробирки (с осадком) в другую, добавляют несколько мл дистиллированной воды. Отмечают изменение растворимости белка. В (тепловая денатурация белков). Нагревание белка вызывает разрыв дисульфидных связей между полипептидными цепями, что приводит к их разворачиванию и изменению конформации макромолекул. При кратковременном нагревании (или относительно невысоких температурах) денатурация не происходит или проявляется в слабой степени. При кипячении происходит быстрое свертывание белка. На скорость и интенсивность процесса тепловой денатурации большое влияние оказывают рН раствора и добавление электролитов. Реактивы: раствор яичного белка; растворы уксусной кислоты, 1 % и 10 %; NaOH, 10 %-ый раствор; хлористый натрий, насыщенный раствор. В пять пробирок наливают по 1–2 мл раствора белка. Первую пробирку нагревают до кипения. К раствору белка во второй пробирке добавляют одну каплю 1 %-го раствора уксусной кислоты и нагревают. К раствору в третьей пробирке прибавляют 5–8 капель 10 %-го раствора уксусной кислоты и нагревают до кипения. В четвертую пробирку добавляют 5–8 капель 10 %-го раствора NaOH и нагревают до кипения. В последнюю пробирку прибавляют 4–5 капель 10 %-го раствора уксусной кислоты и 5–6 капель насыщенного раствора NaCl. Отмечают во всех пробирках изменения в растворимости белка и объясняют причины происходящих процессов. Г (осаждение белков минеральными кислотами). Реакция находит применение для быстрого определения белка в биологических жидкостях. Реактивы: раствор яичного белка; соляная, серная и азотная кислоты, концентрированные. В три пробирки наливают по 1 мл каждой из кислот. Пробирки наклонят под углом 45° и осторожно (из пипетки) по каплям наслаивают по стенке раствор белка (пробирку держат отверстием от себя). На границе должно появиться белое кольцо. Пробирки осторожно встряхивают и добавляют некоторый избыток соответствующей кислоты. Отмечают изменение растворимости белка. Д (осаждение белков органическимикислотами). Наиболее эффективно и специфично необратимое осаждение белков трихлоруксусной и сульфо-салициловой кислотами. Первая осаждает только белки, под действием второй осаждаются также продукты их гидролиза (полипептиды). Реактивы: раствор яичного белка; растворы сульфосалициловой и трихлоруксусной кислот, 10%. В две пробирки наливают по 2 мл раствора белка и добавляют в первую 5–8 капель раствора сульфосалициловой кислоты, во вторую – только же раствора трихлоруксусной кислоты. Е (осаждение белков солями тяжелых металлов). Характер взаимодействия белков с ионами тяжелых металлов (меди, железа, свинца, цинка, ртути и др.) сложен и многогранен. Это и образование комплексных солей, нерастворимых в воде, и изменение электрического заряда белковых молекул вследствие адсорбции на них ионов тяжелых металлов. Денатурация белков солями тяжелых металлов вызывается глубокими нарушениями вторичной и третичной структур макромолекул белка, изменением положения пептидных связей, которое обусловлено в основном разрывом связей между ними (прежде всего дисульфидных). Последним принадлежит важная роль в поддержании вторичной и третичной структур белка. Их разрыв влечет необратимую денатурацию белка. Реактивы: раствор яичного белка; раствор ацетата свинца, 5 %; раствор хлорного железа, 5%; раствор сульфата меди, 5%. В три пробирки наливают по 1–2 мл раствора белка и по каплям добавляют растворы солей: в первую – ацетата свинца, во вторую – сульфата меди, в третью – хлорного железа (до выпадения осадков). Затем прибавляют избыток указанных реактивов и отмечают изменение растворимости белка. Ж (осаждение белков реактивами на алкалоиды). Алкалоиды – азот-содержащие вещества основного характера, обладающие сильным физиологическим действием. В большинстве это гетероциклические соединения, производные пиридина, пиррола, пирролидина, хинолина, пурина и др. Осаждение белков общими реактивами на алкалоиды обусловлено тем, что в состав алкалоидов и аминокислот входят сходные гетероциклические группировки (имидазольные, индольные, пирролиди-новые и др.). Слабое подкисление органической кислотой способствует реакции образования нерастворимых соединений белков, а добавление минеральных кислот, наоборот, затормаживает процесс. Образующиеся осадки растворимы в щелочной среде. Реактивы: раствор яичного белка; пикриновая кислота, 1%-ый раствор; таннин, 10 %-ый раствор; уксусная кислота, 1 %-ый раствор. В пробирки наливают по 1–2 мл раствора белка. Затем в каждую добавляют по 3 капли 1 %-го раствора уксусной кислоты, после чего в первую пробирку приливают 4–5 капель раствора пикриновой кислоты, во вторую – 2–3 капли раствора таннина. Отмечают выпадение осадков.
При оформлении отчета приводят уравнения реакций с указанием окраски растворов или осадков, отмечают выделение газообразных продуктов. Делают вывод о наличии или отсутствии компонентов в изучаемом биологическом объекте, дают объяснения происходящим процессам.
Вопросы коллоквиума:
1. Какое значение рН способствует тепловой денатурации белков и почему? 2. Почему белки растворяются в избытке соляной и серной кислот и не растворяются в азотной кислоте?
Лабораторная работа № 2 «Определение изоэлектрической точки белков» Белки как полиамфолиты содержат одновременно кислотные и основные группы и в зависимости от рН среды могут вести себя либо как поликислоты, либо как полиоснования. Для каждого полиамфолита, сочетающего в цепи кислотные и основные группы, существует определенное, зависящее от его состава, значение рН, при котором количества положительных и отрицательных зарядов в цепи равны. Иными словами, суммарный заряд полиамфолита при этом рН равен нулю. Такое значение рН называется изоэлектрической точкой (ИЭТ). В изоэлектрической точке растворы белков неустойчивы. Молекулы белка с одинаковым количеством положительных и отрицательных зарядов легко выпадают в осадок. Выпадение белка в осадок можно ускорить добавлением водоотнимающих веществ или таннина. При рН, меньших ИЭТ, в цепи начинают доминировать положительные заряды. При достаточно низком рН ионизация всех кислотных групп оказывается подавленной и полиамфолит превращается в полиоснование. Наоборот, при рН, больших ИЭТ, полиамфолит превращается в поликислоту. Степень ионизации, а в случае полиамфолита – удаленность от ИЭТ, сильно влияет на конформационные свойства обычных линейных полиэлек-тролитов, приводя к развертыванию макромолекул и увеличению их линей-ных размеров (явление полиэлектролитного набухания).
Опыт №1.Влияние рН среды на набухание белка Первой стадией растворения любого полимера является его набухание. Набухание — это процесс поглощения полимером низкомолекулярной жидкости, сопровождающийся увеличением объема полимера и изменением конформаций его макромолекул. Большие по размерам молекулы полимера характеризуются низкими значениями коэффициента диффузии. Поэтому смешение осуществляется медленно и его промежуточные стадии легко фиксируются. Набухание не всегда заканчивается растворением. Часто набухание идет до какого-то определенного (максимального) значения и дальнейший контакт с растворителем не изменяет ни массы, ни объема полимера (ограниченное набухание). Состояние набухания характеризуют степенью набухания где m0 и V0 — масса и объем исходного полимера; mt и Vt — масса и объем набухшего полимера к моменту времени t. Таким образом, за процессом набухания можно наблюдать либо периодически взвешивая набухающее вещество (гравиметрический метод), либо измеряя объем жидкости, оставшейся после набухания (объемный метод). Реактивы: желатин пищевой; растворы уксусной кислоты и ацетата натрия, 0,2 М. Оборудование: пипетки 5 и 10 мл; бюксы; часовое стекло; рН–метр; весы аналитические. Изучение влияния рН среды на набухание желатина проводят в растворах следующих составов: Таблица 1.
Значения рН растворов контролируют с помощью рН–метра. Точно взвешенные пластинки желатина (массой порядка 50 мг) вносят в бюксы или пробирки с предварительно приготовленными растворами. Через 60 мин пластинки извлекают из бюксов, осторожно промакивают между листами фильтровальной бумаги и взвешивают на часовом стекле. Вычисляют степень набухания желатина. Строят график зависимости степени набухания α от рН. Объясняют полученные результаты, находят значение ИЭТ.
Опыт №2. Влияние рН среды на осаждение белка Реактивы: желатин, 0,5%-ый раствор; растворы уксусной кислоты и ацетата натрия, 0,2 М; этанол, 96%-ый; таннин, 0,1%-ый раствор. Оборудование: пипетки 5 и 10 мл; пробирки; рН–метр. В шесть пробирок наливают растворы уксусной кислоты и уксусно-кислого натрия в количествах, указанных в табл. 2. Таблица 2.
Затем в каждую пробирку добавляют по 1 мл раствора желатина и хорошо перемешивают, затем прибавляют по 4 мл этилового спирта (или по 1 мл раствора таннина) и снова перемешивают. Через 5–10 мин просматривают все пробирки и оценивают по пятибалльной шкале степень мутности смеси в каждой из них. рН наиболее мутной смеси соответствует изоэлектрической точке белка. Результаты опыта заносят в таблицу, которую составляют по образцу табл. 2. Находят значение ИЭТ белка. Объясняют полученный результат.
Вопросы коллоквиума: 1. Определите рН среды, в которой находится изоэлектрическая точка трипептидов Тре-Фен-Тир; Гис-Ала-Мет; Вал-Фен-Лей; Сер-Ала-Цис. 2. Какой из белков – пепсин (рI 2,75) или казеин (рI 4,6) – и почему более эффективен во взаимодействии с солями стронция?
Лабораторная работа № 3 «Углеводы» Наличие свободных кетонных или альдегидных групп, способных окисляться до соответствующих кислот, одновременно восстанавливая соли металлов, лежит в основе качественного и количественного определения моно- и дисахаридов. Так называемые редуцирующие дисахариды (лактоза, мальтоза) участвуют в характерных реакциях моносахаридов. Нередуцирующие (сахароза) вступают в подобные реакции только после гидролиза. При гидролизе полисахаридов (кипячение с минеральными кислотами) также образуются моносахариды с редуцирующими свойствами.
Опыт № 1. Гексозы Реакция Троммера Реактивы:раствор глюкозы, 5 %; растворы NaOH и CuSO4, 5 %. В пробирку наливают 3 мл раствора глюкозы, 1 мл раствора щелочи и 5 капель раствора CuSO4. Образующийся осадок встряхиванием растворяют, раствор нагревают до кипения, отмечают цвет осадка. Реакция Фелинга Реактивы:раствор глюкозы, 5 %; реактив Фелинга (готовят смешением растворов А, содержащего щелочной раствор тартратов калия-натрия, и раствора Б, содержащего CuSO4, в соотношении 1:1). В пробирку приливают по 1 мл растворов глюкозы и реактива Фелинга, нагревают до кипения, отмечают цвет осадка. 1.3. Восстановление аммиачного раствора AgNO3 Реактивы:раствор глюкозы, 5 %; раствор AgNO3, 1 %; растворы NaOH, 5 % и аммиака, 10 %. К 1 мл раствора AgNO3 прибавляют 1 мл раствора щелочи, по каплям аммиак до растворения серого осадка и 3 мл раствора глюкозы. Смесь нагревают до бурого окрашивания, отмечают цвет осадка. Реакция Барфеда Реактивы:раствор глюкозы, 5 %; раствор уксуснокислой меди, 2,5 %. К 1 мл раствора глюкозы приливают 1 мл реактива Барфеда, смесь нагревают до кипения, отмечают цвет осадка. Реакция с фенилгидразином Реактивы:раствор глюкозы, 5 %; ацетат натрия; ледяная уксусная кислота; фенилгидразин или фенилгидразин солянокислый. 4–5 мл раствора глюкозы подкисляют 5–6 каплями ледяной уксусной кислоты, добавляют 5 капель фенилгидразина или 0,25–0,3 г фенилгидразина солянокислого и такое же количество ацетата натрия. Смесь кипятят на водяной бане до образования осадка. Реакция Селиванова (обнаружение кетоз) Реактивы:раствор фруктозы (несколько крупинок препарата растворяют в необходимом объеме воды); раствор НС1, 25 %; резорцин. К 5 мл раствора фруктозы прибавляют 1 мл раствора кислоты и несколько кристалликов резорцина. Нагревают смесь на водяной бане (80 0С) в течение 5–10 мин до появления окрашивания.
Опыт № 2. Дисахариды 2.1. Определение восстанавливающей способности лактозы (мальтозы) Реактивы:раствор мальтозы (лактозы); растворы NaOH и CuSO4, 5 %. К 2 мл раствора дисахарида приливают 1 мл раствора NaOH и 5 капель раствора CuSO4, нагревают до кипения, отмечают цвет осадка. |
|||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 367. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||||||||||||||
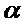 , которую определяют как количество поглощенной полимером жидкости, отнесенное к единице массы или объема полимера.
, которую определяют как количество поглощенной полимером жидкости, отнесенное к единице массы или объема полимера.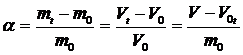 ,
,