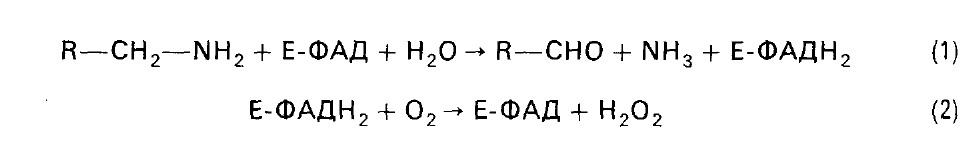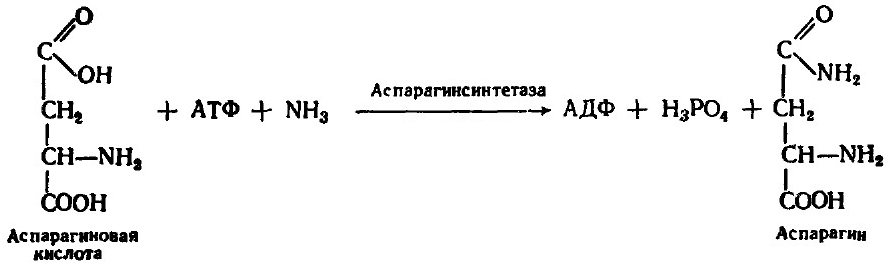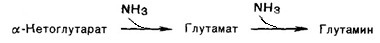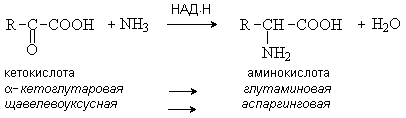Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Реакции по карбоксильной группе1. Декарбоксилирование аминокислот.Простетической группой декарбоксилаз L-аминокислот служит пиридоксальфосфат (активная форма витамина В6).Продуктами декарбоксилирования аминокислот являются амины. Так как они образуются в качестве продуктов жизнедеятельности и обладают высокой физиологической активностью, их называют биогенными аминами. Открыты 4 типа декарбоксилирования аминокислот. Для тканей животных характерно α-декарбоксилирование.
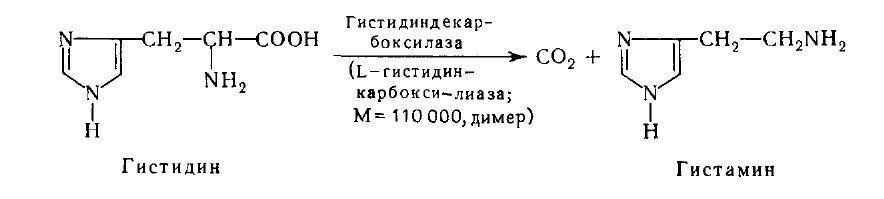
При декарбоксилировании гистидина возникает гистамин. Он вызывает расширение сосудов в очаге воспаления, участвует в секреции соляной кислоты в желудке, что используется в клинике при изучении секреторной деятельности желудка (гистаминовая проба). При повышенной чувствительности к гистамину используют антигистаминные препараты. При декарбоксилировании глутаминовой кислоты образуется НООСCH(NH2)CH2CH2COOH глутаминовая кислота g-аминомасляная кислота Она накапливается в мозговой ткани и представляет собой нейрогуморальный ингибитор. ГАМК используется в клинике как лекарственное средство при некоторых заболеваниях ЦНС. Декарбоксилаза ароматических аминокислот катализирует декарбоксилирование 3,4-диоксифенилаланина (ДОФА), образуется дофамин. Он является предшественником норадреналина и адреналина. Накопление биогенных аминов может вызывать нарушения ряда функций в организме. Существуют специальные механизмы обезвреживания биогенных аминов. Происходит их окислительное дезаминирование с образованием альдегидов и освобождением аммиака. Ферменты - моноамино-и диаминоксидазы. Локализованы преимущественно в митохондриях. Коферментом является ФАД. Процесс является необратимым и протекает в две стадии: 
Пероксид водорода далее распадается на воду и кислород. 2. Образование аминоациладенилатов.Эта реакция взаимодействия аминокислоты с АТФ, катализируется ферментами класса лигаз. С аминоациладенилатов аминокислоты передаются на тРНК. Углеродные скелеты аминокислот могут включаться в ЦТК. Пять аминокислот (фен, лиз, лей, трп, тир) считаются кетогенными, поскольку являются предшественниками кетоновых тел. Большинство других аминокислот называют гликогенными. Они служат в организме источником углеводов. Глюконеогенез усиливается при сахарном диабете, при гиперфункции коркового вещества надпочечников, введении глюкокортикоидов.
ОБЕЗВРЕЖИВАНИЕ АММИАКА В ОРГАНИЗМЕ Главным источником аммиака в организме служит дезаминирование аминокислот и нуклеотидов. Распадается около 70 г аминокислот в сутки. Аммиак является высокотоксичным соединением. Уровень аммиака в крови в норме не превышает 60 мкмоль/л. В опытах на животных показано, что превышение концентрации аммиака в 5 раз является летальным. Пути связывания аммиака 1. Аспарагиновая и глутаминовая кислотыосуществляют первичное связывание NH3в момент его образования в клетке.Ферменты - аспарагинсинтетазаи глутаминсинтетаза- лигазы. Необходимым условием является участие АТФ.
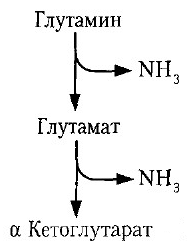
Синтез глутамина происходит особенно активно в мышцах, мозге, печени. Часть аммиака связывается с a-кетоглутаровой кислотой.
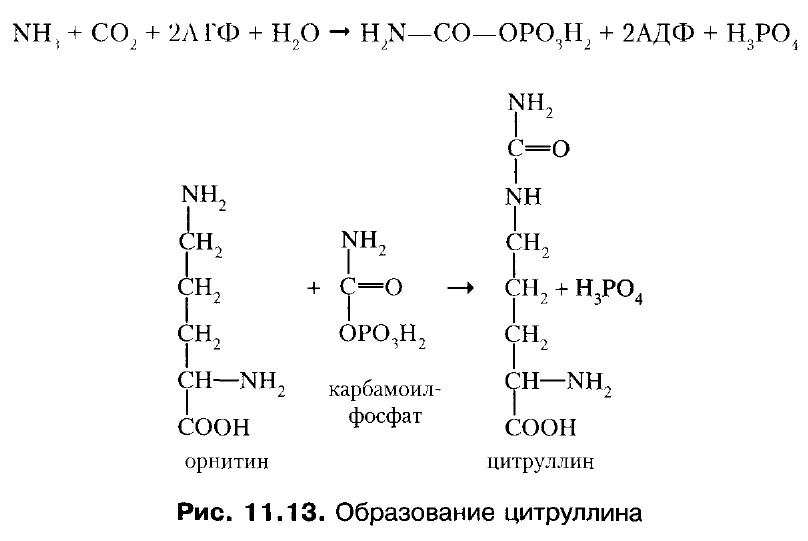
Глутамин и аспарагин выделяются с мочой в небольшом количестве. Предполагают, что они выполняют функцию переноса аммиака в нетоксичной форме. Значительная часть аммиака переносится в печень в виде аланина. Последний образуется из пирувата. Амидирование аспарагиновой и глутаминовой кислот может происходить и в том случае, если они находятся в составе белковой молекулы. Тем самым обеспечивается немедленное связывание аммиака везде, где он возникает в результате обмена веществ. 2. Мочевина - основной конечный продукт белкового обмена у человека и многих животных. Азот мочевины составляет около 90% всего выводимого азота. Синтез мочевины происходит исключительно в печени, т.к. полный набор ферментов орнитинового цикла есть только в гепатоцитах. Этот процесс протекает в несколько стадий, образующих орнитиновый цикл мочевинообразования Кребса. 1. Образование карбамоилфосфата из NH3, CO2 и АТФ при действии карбамоилфосфатсинтетазы.Макроэргическое соединение карбамоилфосфат – метаболически активная форма аммиака: NH3+ CO2 + 2 АТФ + Н2О ® H2N-СО-ОРО3Н2 + 2АДФ + Н3РО4 В организме человека открыты два пути синтеза карбамоилфосфата: а) реакция под действием фермента аммиакзависимой карбамоилфосфатсинтетазы. Протекает в митохондриях клеток печени и используется преимущественно для синтеза аргинина и мочевины; б) реакция, катализируемая глутаминзависимой карбамоилфосфатсинтетазой. Донором аминогруппы является глутамин. Открыта в цитозоле, используется преимущественно для синтеза пиримидиновых нуклеотидов. 2. Конденсация орнитина и карбамоилфосфата, фермент - орнитинкарбамоилтрансфераза.
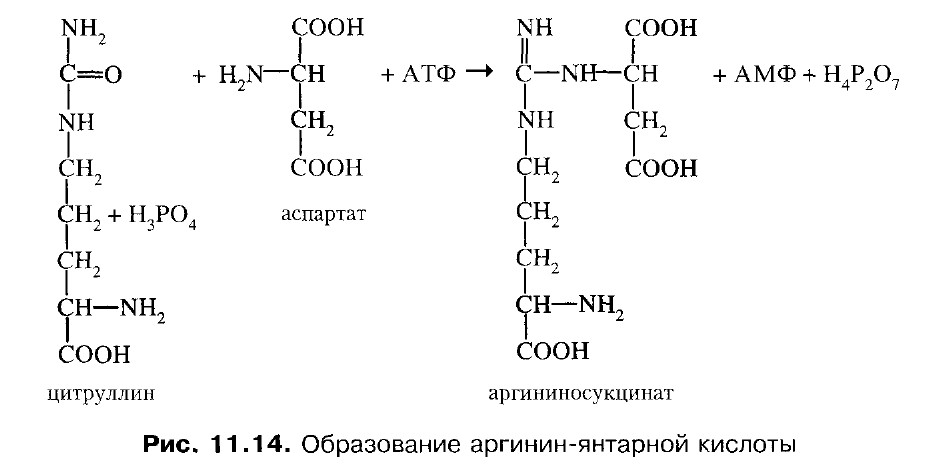
1 и 2 реакции протекают в митохондриях. 3. Цитруллин переходит в цитозоль и там реагирует с аспарагиновой кислотой, образуется аргининосукцинат. Фермент - аргининосукцинатсинтетаза.
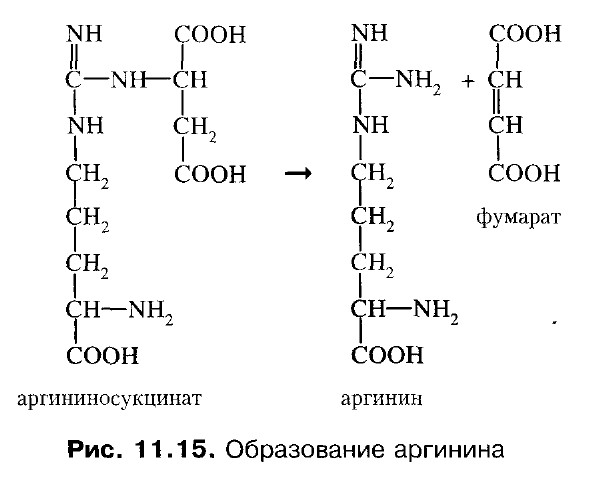
4. Аргининсукцинат распадается на аргинин и фумарат. Фермент – аргининосукцинатлиаза.
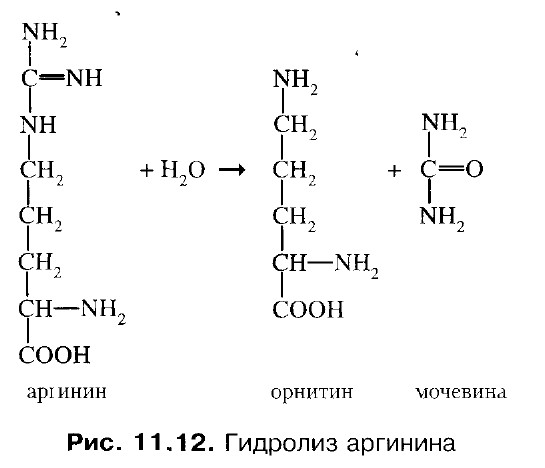
5. Гидролиз аргинина с образованием мочевины. Фермент - аргиназа.
Образовавшийся орнитин вновь вовлекается в цикл образования мочевины. Фумарат превращается в аспартат: фумарат ® пируват ® аспартат На 1 моль синтезирующейся мочевины расходуется 3 моль АТФ. Суммарное уравнение синтеза мочевины:
Концентрация мочевины в сыворотке крови здоровых взрослых людей составляет 2,5-8,3 ммоль/л (660 мг/л). 3. Некоторое количество аммиака выводится с мочой в виде аммонийных солей.Образование аммиака происходит в почках, главным образом из глутамина:
Аммиак акцептирует протон, образуя аммонийную соль. Образование и экскреция аммиака почками представляют собой механизм экскреции протонов (в составе NH4+). Экскреция аммиака с мочой в норме составляет около 0,5 г в сутки. Она повышается при ацидозе (до 20 раз больше нормы). При алкалозе экскреция аммиака отсутствует. 4. Азот выводится в форме креатинина, который образуется из креатина и креатинфосфата, а креатин, в свою очередь – из аминокислот аргинина, глицина и метионина. 5. Часть аммиака используется на биосинтез аминокислот путем восстановительного аминирования a-кетокислот. Это главный путь новообразования аминокислот в организме человека. Даная реакция обратна окислительному дезаминированию аминокислот. Возможно восстановительное аминирование любой кетокислоты. Но активно участвуют в данной реакции a-кетоглутаровая, щавелевоуксусная и пировиноградная кислота:
Остальные аминокислоты образуются в результате реакций трансаминирования аспарагиновой и глутаминовой кислот и аланина с соответствующими кетокислотами. Поэтому аланин, аспарагиновую и глутаминовую кислоты называют первичнымиаминокислотами, а все остальные - вторичными.
|
||
|
Последнее изменение этой страницы: 2018-04-11; просмотров: 236. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

 NH2CH2CH2CH2COOH + СО2
NH2CH2CH2CH2COOH + СО2