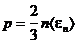Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Работа газа при расширении.Работа расширения газа:
23. Теплоемкость и внутренняя энергия идеального газа. Теплоемкостью какого-либо тела называется величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить его температуру на один кельвин. Если сообщение телу количества тепла dQ повышает его температуру на dT, то теплоемкость по определению равна:
Молярной теплоемкостью (С) называют теплоемкость одного моля газа, а удельной теплоемкостью (c) — теплоемкость единицы массы газа. Связь между удельной с и молярной С теплоемкостями Теплоемкость газа, находящегося в постоянном объеме, называется теплоемкостью при постоянном объеме (Cv), а газа, находящегося при постоянном давлении — теплоемкостью при постоянном давлении (Cp). Уравнение Майера (связь между молярными теплоемкостями Cv и Cp) — Молярные теплоемкости газа Cv и Cp равны Внутренняя энергия идеального газа
Уравнение состояния идеального газа. Изопроцессы. Адиабатический процесс. Газ, потенциальной энергией взаимодействия между молекулами которого можно пренебречь, называется идеальным. Уравнение Менделеева — Клапейрона (уравнение состояния идеального газа)
где т — масса газа, m — молярная масса газа, R — универсальная газовая постоянная, v — количество вещества, Т — термодинамическая температура. Опытные газовые законы, являющиеся частными случаями уравнения Менделеева — Клапейрона для изопроцессов:  а) закон Бойля—Мариотта (изотермический процесс: T=const, m=const)
б) закон Гей-Люссака (изобарический процесс: р=const, m=const)
в) закон Шарля (изохорический процесс: V=const, m=const)
где p1, V1, T1—давление, объем и температура газа в начальном состоянии; p2, V2, T2 — те же величины в конечном состоянии. Адиабатический процесс - это процесс, происходящий без теплообмена с внешней средой. Уравнение адиабаты (уравнение Пуассона) имеет вид
Реальные газы. Уравнение Ван-дер-Ваальса. Газ, потенциальной энергией взаимодействия между молекулами которого нельзя пренебречь, называется реальным. Уравнение Ван дер Ваальса (уравнение состояния реального газа) для одного моля реального газа
Основное уравнение молекулярно-кинетической теории. Основное уравнение молекулярно-кинетической теории связывает параметры состояния газа с характеристиками движения его молекул, т. е. устанавливает зависимость между давлением и объемом газа и кинетической энергией поступательного движения его молекул. Основное уравнение кинетической теории газов,
где <eп> — средняя кинетическая энергия поступательного движения молекулы.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 604. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
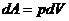 - элементарная работа,
- элементарная работа,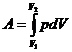 - работа в общем случае, может быть вычислена как площадь под зависимостью p от V на графике в координатах p,V.
- работа в общем случае, может быть вычислена как площадь под зависимостью p от V на графике в координатах p,V.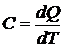 (1).
(1).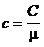 .
.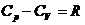 .
.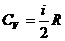 и
и 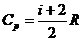 , где i – количество степеней свободы молекул газа.
, где i – количество степеней свободы молекул газа.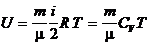 .
.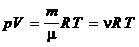 ,
,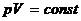 или для двух состояний газа
или для двух состояний газа 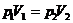 ,
,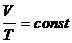 или для двух состояний
или для двух состояний 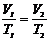 ,
,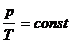 или для двух состояний
или для двух состояний 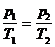 ,
,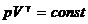 , где g=Cp/CV - показатель адиабаты.
, где g=Cp/CV - показатель адиабаты.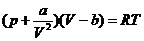 .
.