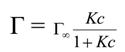Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Уравнение Ленгмюра, его анализ. Изотерма адсорбции, предельная адсорбция.Основные положения теории Ленгмюра следующие: - адсорбция молекул происходит не на всей поверхности адсорбента, а только на адсорбционных центрах, где имеются участки с наиболее нескомпенсированными силовыми полями; -каждый адсорбционный центр может удерживать только одну молекулу адсорбата, при этом адсорбированные молекулы не взаимодействуют со свободными молекулами, что приводит к образованию мономолекулярного слоя поглощаемого вещества; -процесс адсорбции обратим и носит динамический характер, т.к. адсорбированные молекулы удерживаются адсорбционными центрами только в течение определенного промежутка времени, после чего происходит десорбция этих молекул и адсорбция такого же числа новых молекул. Исходя из этих положений, Ленгмюр предложил уравнение адсорбции: Где Г∞- значение предельной адсорбции; с – равновесная концентрация адсорбента системе; К – константа адсорбционного равновесия. Зависимость адсорбции от концентрации ПАВ (изотерма адсорбции) имеет вид: На кривой четко видны три участка: I - ый участок – это прямая линия, выходящая из начала координат. Действительно, при малых концентрациях, когда с → 0 и (1 + Кс) ≈1, уравнение принимает вид Г = Г∞∙Кс, т.е. величина адсорбции прямо пропорциональна концентрации или давлению адсорбата. III – участок – соответствует прямой, параллельной оси абсцисс, что означает, что адсорбция достигла своего предельного значения. При этом Кс ›› 1 и (1 + Кс) ≈ Кс, тогда Г = Г∞ (произошло насыщение поверхности адсорбента молекулами адсорбата, так как сформировался мономолекулярный слой).  II – ой участок соответствует криволинейной части графика и описывается полным уравнением Ленгмюра. 9. Адсорбция на границе твердое тело – жидкость, еѐ особенности. Факторы еѐ определяющие: величина удельной поверхности и сродство адсорбента к адсорбтиву, природа растворителя, природа поглощаемого вещества, влияние концентрации растворѐнного вещества на процесс адсорбции, влияние температуры. Существенным отличием адсорбции веществ из растворов является конкуренция между растворенным веществом и растворителем за возможность взаимодействовать с адсорбционными центрами на поверхности твердого адсорбента. Рассматривая этот вид адсорбции, остановимся на следующем: 1. При адсорбции из раствора важным фактором является величина удельной поверхности адсорбента и его сродство к поглощаемому веществу. Гидрофильные адсорбенты (силикагель, глины, пористые стекла) хорошо поглощают полярные вещества, а гидрофобные (сажа, активированный уголь) -–неполярные вещества. 2. Природа растворителя:Чем хуже данный растворитель смачивает поверхность адсорбента и чем хуже растворяет вещество, тем лучше будет происходить адсорбция растворенного вещества. 3. Природа поглощаемого вещества: а) выполняется правило «подобное взаимодействует с подобным», т.е. должно быть сродство между адсорбентом и адсорбтивом; б) Выполняется правило Шилова: Чем больше растворимость вещества в данном растворителе, тем хуже оно адсорбируется на поверхности твердого адсорбента. в) правило Ребиндера (правило уравнивания полярностей Ребиндера): На поверхности раздела фаз прежде всего адсорбируются те вещества, при адсорбции которых происходит выравнивание полярностей соприкасающихся фаз, причѐм с увеличением разности полярности фаз способность к адсорбции этих веществ возрастает. Эффективней всего адсорбируются молекулы веществ, имеющих дифильное строение. В этом случае идѐт эффективная адсорбция на твердом адсорбенте с самопроизвольной четкой ориентацией их молекул на границе раздела, выравнивающей полярности фаз. Полярный фрагмент молекулы обращен всегда к полярной фазе – к воде, силикагелю, а неполярный фрагмент – к неполярной (гидрофобной) фазе –активированному углю, маслу. 4. Влияние концентрации растворенного вещества на процесс адсорбции при постоянной Т описывается уравнением Ленгмюра. 5. Повышение температуры снижает эффективность адсорбции. Это объясняется ослаблением взаимодействия между адсорбентом и адсорбатом.
10.Адсорбция растворѐнного в жидкости вещества на твѐрдом адсорбенте, молекулярная адсорбция и ионная адсорбция. Молекулярная адсорбция – адсорбция из растворов неэлектролитов. В этих случаях растворенное вещество адсорбируется на поверхности твердого тела в виде молекул. Особенности молекулярной адсорбции: наряду с растворѐнным веществом адсорбируются молекулы растворителя. Поэтому для адсорбции растворѐнного вещества его молекулы должны вытеснять с поверхности молекулы растворителя. Ионная адсорбция – адсорбция из растворов сильных электролитов. В этом случае растворённое вещество адсорбируется в виде ионов Ионная адсорбция. Факторы, влияющие на ионную адсорбцию: химическая природа адсорбента, химическая природа ионов (лиотропные ряды Гофмейстера, влияние заряда иона на адсорбцию, правило Панетта – Фаянса). Особенности ионной адсорбции: 1. Адсорбируются заряженные частицы (ионы), а не молекулы. 2. Адсорбция происходит только на полярных адсорбентах, поэтому её часто называют полярной адсорбцией. 3. Адсорбция сопровождается образованием двойного электрического слоя (ДЭС). 4. Адсорбция является избирательной, т.е. на каждом данном адсорбенте катионы и анионы адсорбируются неодинаково. 5. В основе ионной адсорбции лежат химические силы, и она чаще всего кинетически необратима. 6. Для ионной адсорбции характерно явление обменной адсорбции Факторы: 1. Химическая природа адсорбента Чем более полярным является адсорбент, тем лучше он адсорбирует ионы из водных растворов. На активных центрах, несущих положительный заряд, адсорбируются анионы(-), на отрицательных – катионы(+). 2. Химическая природа ионов а) На адсорбцию ионов большое влияние оказывает величина радиуса иона. С увеличением кристаллического радиуса иона возрастает адсорбционная способность. В соответствии с этим ионы можно расположить в ряды по возрастающей способности к адсорбции. Эти ряды называют лиотропными рядами Гофмейстера: Li ‹ Na ‹ K ‹ Rb ‹ Cs б) Чем больше заряд иона, тем сильнее адсорбция: K ‹‹ Са ‹‹ Al Правило Панетта-Фаянса: На кристаллической поверхности адсорбируются те ионы, которые способны достраивать кристаллическую решетку и дают труднорастворимое соединение с ионами, входящими в кристалл. 12.Ионообменная адсорбция, еѐ особенности. Вещества иониты. Их деление на катиониты, аниониты и амфолиты. Деление ионитов по химической природе каркаса (неорганические, минерально-органические). Использование ионитов. Ионообменная адсорбция – это процесс, при котором твердый адсорбент обменивает свои ионы того же знака из жидкого раствора. Ионообменная адсорбция характерно: 1) эта адсорбция специфична, т.е. к обмену способны только определённые ионы, по своей природе этот процесс приближается к химическим явлениям 2) эта адсорбция не всегда обратима 3) протекает медленнее, чем молекулярная адсорбция 4) при этой адсорбции может меняться рН среды Иониты - вещества, проявляющие способность к ионному обмену при контакте с растворами электролитов. Большинство ионитов – твёрдые, нерастворимые, ограниченно набухающие вещества. Катиониты - способные обменивать свои положительные ионы Аниониты— которые способны обменивать свои отрицательно заряженные ионы на ионы внешней среды Амфолиты - молекулы, в структуре которых присутствуют как кислотные, так и основные группы. Деление ионитов по химической природе каркаса – на неорганические, органические и минерально-органические. Неорганические и органические иониты могут быть природными и синтетическими. Минерально-органические состоят из органического полиэлектролита на минеральном носителе. Иониты применяются для очистки, разделения и концентрирования веществ из водных и газообразных сред. Хроматография. Понятия об адсорбционной, распределительной, ионообменной хроматографии. Хемосорбционная хроматография. Молекулярно-ситовая хроматография (или гельфильтрация). Деление хроматографии по технике эксперимента: колоночная, бумажная и тонкослойная хроматография. Хроматография – метод анализа и разделения смеси веществ, основанный на их различной адсорбции. Хроматография подразделяется: 1)Адсорбционная - основана на различной адсорбции разделяемых веществ. 2)Распределительная - основана на различии в растворимости и распределения веществ между двумя несмешивающимися жидкости. 3)Ионообменная - по обмену ионами между раствором и адсорбентом 4)Хемосорбционная – основана на различии в константах химической реакции. 5)Молекулярно-ситовая – основана на разделение смеси веществ с различным размером молекул. Колоночная хроматография — осуществляется пропусканием исследуемого раствора через стеклянную трубку, заполненную порошкообразным поглотителем. Бумажная хроматография - метод, основанный на распределении веществ между подвижной и неподвижной жидкими фазами. Тонкослойная хроматография - основанный на различной скорости перемещения компонентов смеси в плоском тонком слое сорбента при их движении в потоке подвижной фазы. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 631. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |