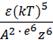Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Двойной электрический слой (ДЭС), современные представления о строении ДЭС.Из строения мицеллы следует, что у неё на границе раздела двух фаз возникает тонкий поверхностный слой из пространственно разделённых электрических зарядов противополжного знака, который и носит название ДВОЙНОГО ЭЛЕКТРИЧЕСКОГО СЛОЯ (ДЭС). В ДЭС происходит полная компенсация суммарного заряда твердой поверхности суммарным зарядом противоионов и на границе ДЭС с дисперсионной средой потенциал равен нулю. При движении частицы ДЭС разрывается. Современные представления о строении ДЭС: ·ДЭС образован потенциалопределяющими ионами, находящимися на поверхности твердой частицы и эквивалентным количеством противоионов, находящихся в дисперсионной среде вблизи поверхности твердой частицы. ·Потенциалопределяющие ионы прочно связаны с твердой частицей хемосорбционными силами и равномерно распределены по ее поверхности. ·Слой противоионов, компенсирующих заряд твердой поверхности, имеет сложное строение и состоит из двух частей: адсорбционного слоя и диффузного слоя. ·Адсорбционный слой противоионов примыкает к заряженной поверхности твердой частицы. Те противоионы, которые находятся в этом пространстве, называются адсорбционными противоионами. Они связаны с заряженной твердой частицей двумя видами сил – адсорбционными и электростатическими. Эта связь является настолько прочной, что противоионы адсорбционного слоя перемещаются вместе с твердой частицей, не отрываются от нее, образуя с ней единое кинетическое целое – коллоидную частицу. Противоионы адсорбционного слоя равномерно распределены в слое. ·Диффузный слой имеет толщину δ, его образуют те противоионы, которые находятся от заряженной поверхности на расстоянии, большем d, но в пределах расстояния δ. Эти противоионы притягиваются к частице только электростатическими силами, а следовательно, менее прочно, чем противоионы адсорбционного слоя. При движении твердой частицы они от нее отрываются.  ·Полное падение дзета-потенциала в ДЭС называется термодинамическим потенциалом φ0: В ДЭС происходит полная компенсация суммарного заряда твердой поверхности суммарным зарядом противоионов и на границе ДЭС с дисперсионной средой потенциал равен нулю. Электрокинетический потенциал (или дзета-потенциал) как важнейшая характеристика ДЭС. Факторы, определяющие величину дзета- потенциала. Электрокинетические явления в живых организмах. Место разрыва при перемещении твердой и жидкой фаз относительно друг друга называется плоскостью скольжения или границей скольжения. Потенциал на плоскости скольжения называетсяЭЛЕКТРОКИНЕТИЧЕСКИМ ПОТЕНЦИАЛОМ (или дзета-потенциалом). -Чем больше размыт двойной слой, тем больше и дзета-потенциал. Если слой предельно сжат, то дзета-потенциал равен 0. Это соответствует изоэлектрическому состоянию, и система не реагирует на электрический ток -Дзета-потенциал зависит от концентрации электролита-стабилизатора – чем она больше, тем меньше дзета-потенциал, -Зависит от заряда противоиона - чем он больше, тем больше дзета-потенцал. Устойчивость коллоидных систем падает с понижением дзета-потенциала. При дзета-потенциале равном нулю коллоидная система перестает существовать. Электрокинетические свойства коллоидных частиц играют большую роль в живых организмах. При движении крови в артериях возникает потенциал течения. При восприятия звука органами слуха также возникает такой потенциал. Седиментационная и агрегативная устойчивость коллоидных систем. Агрегативная устойчивость - способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е.размер частиц и их индивидуальность. Агрегативная устойчивость обусловлена наличием у частиц дисперсной фазы электрического заряда и сольватной оболочки. Способность дисперсных систем сохранять определенное распределение частиц по объему дисперсионной среды называется седиментационной устойчивостью. Седиментационная устойчивость коллоидных систем зависит от размеров их частиц чем меньше размер частиц, тем более устойчив коллоидный раствор. Явление коагуляции коллоидных систем. Две стадии коагуляции: скрытая и явная коагуляции. Факторы, вызывающие коагуляцию. Коагуляция - процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет седиментационную устойчивость. Коагуляция самопроизвольный процесс, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии. Факторы коагуляции: Коагуляция возникает под действием разнообразных внешних воздействий. К ним относятся: изменение температуры; действие электрического и электромагнитного полей; действие видимого света; облучение элементарными частицами; механическое воздействие; добавление электролитов и др. Процесс коагуляции имеет две стадии: скрытую и явную. На скрытой стадии происходит формирование коллоидного раствора гидроксидов и образование микрохлопьев. А затем на явной стадии процесса образуются крупные хлопья размером 1—3 мм, которые, обладая высокой сорбционной способностью, могут дополнительно извлекать примеси из воды. Коагуляция коллоидных систем электролитами, порог коагуляции. Правило Шульце-Гарди. Определение порога коагуляции. Коагуляция смесями электролитов. Коагуляция электролитами происходит при сравнительно невысокой концентрации добавляемого электролита. Коагуляцию вызывают все электролиты, так как при введении их в коллоидную систему происходит сжатие диффузного слоя, снижение ζ-потенциала, что приводит к разрушению коллоидной системы. Минимальная концентрация электролита, вызывающая за данный промежуток времени определённый видимый эффект коагуляции, называется порогом коагуляции (γ) или критической концентрацией. Эта величина служит сравнительным критерием агрегативной устойчивости дисперсной системы. Порог коагуляции принято выражать в ммоль/л. Коагуляцию вызывает ион противополжного знака заряду коллоидной частицы: для положительных – анион, для отрицательных – катион, вводимого в систему электролита. Правило Шульце-Гарди Коагулирующее действие иона тем выше, чем выше его заряд. При увеличении заряда иона на единицу, порог концентрации уменьшается на один порядок По современной теории коагуляции электролитами, разработанной Б.В. Дерягиным и Л.Д. Ландау, порог коагуляции определяется уравнением:
γ = С
где С – константа, зависящая от числа зарядов катиона и аниона; k – константа Больцмана; е – заряд электрона, Т – температура (в К), ε – диэлектрическая проницаемость раствора, А – константа вандерваальсова притяжения; Z – величина заряда иона. Если применяется смесь электролитов, то механизм коагуляции осложняется. Происходит смещение адсорбционного равновесия, которое сопровождается перераспределением ионов двойного слоя и изменением порога коагуляции. Наблюдаемые при этом явления можно свести к 3 следующим: антагонизм, синергизм, аддитивность. 1)Аддитивность- коагулирующее действие смеси равно общей сумме коагулирующих эффектов составляющих её электролитов. 2)Антагонизм- действие одного электролита ослабляется при добавлении другого. 3)Синергизм-действие одного электролита усиливается при добавлении другого. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 679. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |