
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
ОСНОВНЫЕ СВЕДЕНИЯ ПО ХИМИИ ДЛЯ РЕСТАВРАТОРОВ ПРОИЗВЕДЕНИЙ СТАНКОВОЙ МАСЛЯНОЙ И ТЕМПЕРНОЙ ЖИВОПИСИ (ХИМИЧЕСКИЕ ПРОЦЕССЫ И ОСНОВНЫЕ МАТЕРИАЛЫ)⇐ ПредыдущаяСтр 18 из 18
ОСНОВНЫЕ СВЕДЕНИЯ О РАСТВОРАХ. ПОНЯТИЕ О КИСЛОТНОСТИ И ЩЕЛОЧНОСТИ СРЕДЫ
РАСТВОРЫ
Растворы находят широкое применение при реставрации произведений живописи. Реставраторы используют растворы клеев, смол, лаков, пластификаторов, моющих веществ, антисептиков и др. Концентрация растворов. Одной из основных характеристик растворов является их концентрация. Концентрацией раствора называется весовое (или объемное) содержание растворенного вещества в определенном весовом количестве или в определенном объеме раствора. Процентная концентрация раствора показывает, сколько процентов составляет масса растворенного вещества от массы всего раствора. Зависимость между процентной концентрацией раствора (С%), массой растворенного вещества (m1) и массой раствора (m2) выражается формулой С%=100 Для практических целей пользуются определением концентрации растворов по содержанию сухого остатка. Самый  __________ * Плотностью тела называется масса единицы объема d= 176 доступный и легкий способ определения концентрации по содержанию сухого остатка, например в клеевом растворе, следующий. Стаканчик для взвешивания (бюкс) вывешивается на технохимических весах или, для большей точности, на аналитических. Массу стаканчика с крышкой обозначают через а. В стаканчик вносят несколько мл раствора, накрывают крышкой и снова взвешивают. Массу стаканчика с крышкой и раствором обозначают через б. Для удаления растворителя стаканчик с раствором ставят в сушильный шкаф (чаще при 100 — 105°С) до достижения постоянного веса, то есть до полного улетучивания растворителя. После чего стаканчик накрывают крышкой и ставят в эксикатор над хлористым кальцием примерно на 1 час. После остывания в эксикаторе стаканчик с осадком взвешивается; масса стаканчика с крышкой и осадком обозначается через в. Тогда концентрация раствора с%= Если не требуется особенно большой точности, концентрацию раствора можно определить по плотности*. В соответствующих справочниках приводятся таблицы, в которых для большого количества растворов указываются концентрации, соответствующие их плотности. Таким способом часто определяют концентрацию растворов спиртов, кислот, щелочей. Плотность жидкости, а также раствора может быть определена при помощи пикнометра, гидростатических весов, ареометра и других приборов. Наиболее быстро, с точностью до 1%, плотность жидкости измеряется ареометром. Ареометр представляет собой пустотелый стеклянный поплавок, шарик которого заполнен дробью или ртутью. Верхняя часть его вытянута в виде узкой трубки, на которой нанесены де- __________ * Плотность растворов меняется в зависимости от их концентрации. ления, соответствующие различным значениям плотности. Ареометр калибруется при определенной температуре, которая указывается на шкале. Для того чтобы увеличить точность измерения, изготавливаются наборы ареометров, каждым из которых можно измерять плотность в очень узком интервале. Такие наборы имеются для измерения плотности жидкостей легче и тяжелее воды. При определении плотности жидкости (раствора) в раствор, налитый в стеклянный цилиндр, опускают ареометр. Следует подобрать такой ареометр, который погрузится в жидкость на такую глубину, что уровень жидкости в цилиндре попадет на шкалу ареометра. Во всех случаях следует отметить по нижнему мениску деление шкалы ареометра, совпадающее с уровнем жидкости в цилиндре. Существуют специальные ареометры, сразу дающие нужную характеристику жидкости. Для этилового спирта, например, имеются специальные спиртометры, сразу показывающие процентное содержание спирта. Плотность растворов можно определять и с помощью пикнометров той или иной конструкции. Предварительно взвешенный сухой пикнометр заполняют дистиллированной водой и помещают в термостат*. После 5-минутного выдерживания в термостате доводят уровень воды в пикнометре до метки. Если уровень окажется выше метки, избыточное количество жидкости удаляют фильтровальной бумагой. Затем вынимают пикнометр из термостата, вытирают фильтровальной бумагой и через 5 — 10 минут взвешивают на аналитических весах. Обозначив: g2— вес пустого пикнометра в г, g1 — вес пикнометра с водой, d0 — плотность воды (в г/см3) при выбранной __________ * Для поддержания постоянной температуры употребляют водяной термостат, снабженный терморегулятором. 177 температуре термостата получаем объем пикнометра в см3: V= Таким же образом заполняют сухой пикнометр исследуемой жидкостью, взвешивают (g3) и находят плотность (в г/см3) по формуле: d= Определение плотности производят три раза и берут среднее арифметическое с точностью до третьего знака.
АКТИВНАЯ КИСЛОТНОСТЬ СРЕДЫ (рН) И ЕЕ ИЗМЕРЕНИЕ
Диссоциация на ионы растворенных в воде электролитов (кислот, оснований, солей). Вещества, молекулы которых под действием растворителя диссоциируют (распадаются) на ионы, называются электролитами. Растворы электролитов проводят электрический ток. К ним относятся кислоты, основания и соли. Так как диссоциация представляет собой обратимый процесс, то в растворе между диссоциацией и моляризацией (переход в недиссоциированные молекулы) наступает состояние подвижного равновесия. Степень диссоциации (ά) представляет собой ту долю растворенного электролита, которая распалась на ионы ά= По способности к диссоциации на ионы различают сильные и слабые электролиты. Сильные электролиты в значительной степени или целиком диссоциируют на ионы. К сильным электролитам относятся минеральные соли щелочных и щелочно-земельных металлов, а также галогениды, перхлораты и нитраты некоторых металлов. Минеральные кислоты и щелочи являются сильными электролитами, но в концентрированных растворах они диссоциированы не полностью. К слабым электролитам относятся почти все органические соли, кислоты и основания, фенолы, амины, некоторые минеральные кислоты, например Н2СО3, H2S, многие основания металлов (кроме оснований щелочных и щелочно-земельных металлов), а также нашатырный спирт — NH4OH. Слабые электролиты в воде частично распадаются на ионы, и диссоциация их обратима, например уксусная кислота СН3СООН К растворам слабых электролитов приложим закон действующих масс. На основании этого закона константа равновесия, например, для уксусной кислоты, имеет следующее выражение: К= В квадратных скобках указаны равновесные концентрации Н+, СН3СОО- — ионов в г-ион/л, а концентрация недиссоциированных молекул уксусной кислоты — в молях/л**. Константа равновесия для случаев ионизации получила название константы электролитической диссоциации. Эта константа у слабых электролитов не зависит от концентрации раствора. С изменением температуры константа диссоциации электролита изменяется. Константа диссоциации имеет постоянное значение (при данной температуре) только для слабых электролитов. Для сильных электролитов подобного __________ * ** Грамм-ионом (г-ион) называется весовое количество иона, выраженное в граммах и численно равное сумме весов атомов, составляющих данный ион. Например, веса грамм-ионов равны: Н+ — 1 г, ОН- — 17 г, СН3СОО- —59 г. Молем, или грамм-молекулой, называют количество вещества, масса которого в граммах численно равна молекулярному весу вещества; например, грамм-молекула (моль) водорода — Н2 равна (округленно) 2 г, моль воды — Н2О — 18 г, уксусной кислоты — СН3СООН — 60 г. 178 постоянства не наблюдается. Чем константа диссоциации кислот и оснований меньше, тем слабее данный электролит. Например, уксусная кислота (К=1,85Х10-5) приблизительно в 10 раз слабее муравьиной (К=1,8Х X10-4). Диссоциация воды. Концентрация водородных ионов. Вода, хотя и очень слабо, проводит электрический ток, то есть обладает электропроводностью. Она диссоциирует в малой степени на ионы по уравнению H2O Константа диссоциации воды (К) определена опытным путем и равна 1,8X10-16 при 22°. Концентрация ионов водорода и гидроксила очень незначительна, так как расчет показывает, что из 556 миллионов молекул воды на ионы распадается только одна. Тем не менее, ионизация воды имеет очень большое значение. Из выражения (1) имеем: [Н+][ОН-]=К[Н2О]. [Н2О] — концентрация воды в литре Произведение концентрации водородных [Н+] и гидроксильных [ОН-] ионов в воде и разбавленных водных растворах (выраженных в грамм-ион на литр) называется ионным произведением и обозначается через Кв=10-14 (при 22°). В чистой воде и нейтральных водных растворах концентрации водородных и гидроксильных ионов (в г-ион/л) равны между собой, так как при диссоциации образуется одинаковое число ионов Н+ и ОН-: [Н+]=[ОН-] =10-7 г-ион/л. Таким образом, для нейтральной среды имеем: [Н+]=10-7 г ион/л [ОН-] =10-7 г-ион/л. В кислых средах [Н+] больше [ОН-]. При повышении [Н+] величина [ОН-] уменьшается, но так, что произведение концентрации водородных и гидроксильных ионов остается постоянным и равным Кв=10-14. В щелочных средах [Н+] меньше [ОН-] и в этом случае произведение концентрации водородных и гидроксильных ионов остается постоянным и равным 10-14. О степени кислотности и щелочности среды можно судить по концентрации ионов водорода. Если [H+] = 100, 10-1, 10-2, 10-3, 10-4, 10-5, 10-6, то среда кислая; в щелочной среде [Н+] = 10-8, 10-9, 10-10, 10-11, 10-12, 10-13, 10-14. Водородный показатель рН. Для количественной характеристики реакции среды на практике обычно приводят не концентрацию водородных ионов, а ее отрицательный десятичный логарифм. Эта величина называется «водородным показателем» и обозначается через рН. Таким образом, рН=-lg[H+]. Например, если [Н+]=10-5, то рН=5; если [H+]=10-7, то рН=7. Водородный показатель — величина, характеризующая концентрацию водородных ионов и численно равная отрицательному десятичному логарифму этой концентрации, выраженной в грамм-ион на литр. В более кислом растворе концентрация ионов водорода выше, а значение рН меньше, в более щелочном растворе концентрация 179 Tаблица 9 Концентрация ионов водорода и водородный показатель в различных средах
ионов водорода ниже, а значение рН больше (см. табл. 9). Общая и активная кислотность. Определение рН. Следует различать общую и активную кислотность или щелочность. Общая кислотность (щелочность) характеризуется нормальностью, то есть числом грамм-эквивалентов* кислоты (щелочи), содержащейся в литре раствора. Но количество свободных (активных) ионов водорода (или ионов гидроксила) может быть меньше общего их количества в растворе. Под активной кислотностью понимают концентрацию свободных (диссоциированных) ионов водорода (или гидроксила). Величина рН дает количественную оценку только активной кислотности или щелочности. При одинаковой нормальной концентрации у различных по силе кислот активная кислотность различна. Так, например, __________ * Грамм-эквивалентом называется количество граммов вещества, равное его эквиваленту. Эквивалент кислоты равен ее молекулярному весу, деленному на валентность, то есть на число атомов водорода в молекуле кислоты, способных замещаться металлами. Эквивалент основания равен его молекулярному весу, деленному на валентность соответствующего металла. Раствор, содержащий в литре 1 грамм-эквивалент растворенного вещества, называется однонормальным или просто нормальным раствором и обозначается буквой «Н»; 0,1 грамм-эквивалент растворенного вещества — децинормальным — 0,1 Н; 0,01 грамм-эквивалент — сантинормальным — 0,01 Н. децинормальные (0,1 Н) растворы соляной (НСl) и уксусной (СН3СООН) кислот, имея одинаковую общую кислотность, показывают различные значения рН (для HCI рН=1,02, для СН3СООН рН = 2,89). Так как общая кислотность раствора включает в себя как диссоциированную (активную) часть, так и недиссоциированную часть кислоты, то практически определить ее можно титрованием. При этом к раствору кислоты добавляют столько щелочи, сколько нужно для того, чтобы связать всю кислоту. Так же определяется общая щелочность, только титрование ведут кислотой. Активную кислотность определяют рН-метрией двумя методами: колориметрически и электрометрически. Колориметрический метод определения рН основан на свойстве некоторых веществ, называемых кислотно-щелочными индикаторами, изменять свою окраску в зависимости от степени активной кислотности или щелочности. Обычно это азосоединения, производные трифенилметана и другие органические соединения, молекулы которых претерпевают структурные изменения в зависимости от реакции среды. Индикаторы эти (по теории Оствальда) являются слабыми кислотами или слабыми основаниями, окраска которых зависит от степени диссоциации. Например, лакмус окрашивается в красный цвет в кислых растворах и в синий цвет — в щелочных. 180 Кислотная форма лакмуса, то есть недиссоциированные молекулы, имеет красную окраску, а щелочная форма (анионы) — синюю. При концентрации обеих форм, равных между собой, окраска раствора индикатора будет фиолетовой. Наш глаз имеет ограниченную способность к восприятию окрасок и обычно перестает замечать присутствие одной из окрашенных форм индикатора наряду с другой его формой, если концентрация ее раз в 10 меньше концентрации последней. Вследствие этого окраска любого индикатора изменяется не при всяком изменении рН, а лишь внутри определенной области значения рН, называемой интервалом перехода индикатора. Каждый индикатор характеризуется интервалом перехода. Так, например, лакмус меняет окраску от красного до синего в пределах рН 5 — 8, фенолфталеин — от бесцветного до красного в пределах 8,2 — 10, метиловый оранжевый — от красного до желтого в пределах 3,1 — 4,4. Покраснение лакмуса указывает на то, что рН используемого раствора 5 или ниже. Посинение лакмуса указывает на то, что рН раствора 8 или выше. Внутри области перехода (рН 5 — 8) глазом будет восприниматься фиолетовая окраска лакмуса. Для определения рН испытуемого раствора пользуются реактивными бумагами, которые приготавливаются пропиткой тонкой фильтровальной бумаги раствором соответствующего индикатора. Полоску индикаторной бумаги погружают в испытуемый раствор или наносят на нее каплю раствора. В реставрационной практике удобно пользоваться приблизительным определением рН с помощью универсальных индикаторов. Они представляют собой смеси двух или нескольких индикаторов, подобранных так, чтобы окраска их менялась в широком интервале значений рН. Одним из удобных универсальных индикаторов является смесь из индикаторов метилового красного и тимолового синего (в 100 мл 70%-ного раствора этилового спирта растворяют 0,375 г тимолового синего и 0,125 г метилового красного) (см. табл. 10). Таблица 10 Влияние рН раствора на окраску индикатора, приготавливаемого из смеси метилового красного и тимолового синего
Можно применять универсальный индикатор, представляющий собой смесь нескольких индикаторов. Такой индикатор выпускается в продажу под маркой ЭИ В—1. Еще удобнее проводить приблизительное определение рН с помощью универсальной индикаторной бумаги*. Точность данных, полученных с помощью универсальных индикаторов, — около одной единицы шкалы рН. В лабораторных условиях после приблизительного определения рН с помощью универсального индикатора проводят точное определение рН раствора методом колориметрического титрования. Для колориметрического определения рН растворов определяют цвет, который принимает индикатор в испытуемом растворе и в серии стандарт- __________ * Универсальная индикаторная бумага выпускается лабораторией латвийского отделения Всесоюзного химического общества им. Л. И. Менделеева, Прилагаемая к индикатору цветовая шкала показывает, какие окраски соответствуют различным значениям рН в пределах от 1 до 10. 181 ных буферных* растворов с различным рН: рН испытуемого раствора равен рН того буферного раствора, к которому цвет испытуемого раствора наиболее близок. В лабораториях, где постоянно приходится определять рН, пользуются специальным прибором Михаэлиса, а котором имеется комплект пробирок, содержащих рассчитанное количество индикаторов **. Во всех определениях, требующих точности свыше 0,1 рН, а также при исследованиях в мутных и окрашенных растворах пользуются электрометрическим — потенциометрическим способом. Для таких измерений рН в лабораториях используются рН-метры различных марок, позволяющие производить измерения как в милливольтах, так и в единицах рН по одной и той же шкале. Устройство приборов и правила работы с ними подробно изложены в инструкциях, прилагаемых заводом-изготовителем. Влияние кислотности и щелочности среды на сохранность произведений. Реакция нейтрализации. Кислотные свойства среды определяются действием водородных ионов; щелочные свойства определяются действием гидроксильных ионов. Водородные и гидроксильные ионы занимают особое место среди других ионов благодаря резко выраженному влиянию их на физико-химические свойства материалов и течение многих химических реакций. __________ * Буферными называются растворы с устойчивой концентрацией водородных ионов и, следовательно, с определенным рН, почти не зависящим от разведения и лишь слабо изменяющимся при прибавлении к раствору небольших количеств сильной кислоты и щелочи. Такими свойствами обладают растворы, содержащие слабую кислоту или слабое основание совместно с их солью, например уксусную кислоту и уксуснокислый натрий. ** К прибору прилагается подробная инструкция колориметрического определения рН исследуемого раствора. Многие процессы, обусловливающие ускоренное разрушение произведений живописи, протекают при высокой кислотности или щелочности среды. При наличии кислой среды интенсивно разрушаются целлюлозосодержащие материалы: дерево, бумага, картон, ткани из хлопка, льна, пеньки. Многие пигменты неустойчивы к действию кислот или щелочей. Жиры и масла под действием водных растворов щелочей и минеральных кислот омыляются (гидролизуются), то есть разлагаются на глицерин и жирные кислоты или их соли. Белковые клеи (желатина, рыбий клей, казеин) под действием кислот и щелочей подвергаются либо денатурации, либо гидролизу*. Кислоты вызывают разрушение желтковой эмульсии, а также расщепление комплексов жировых и белковых соединений, из которых состоит желток. Крепкие кислоты и щелочи денатурируют белок яйца. Щелочи омыляют (гидролизуют) воски на спирт и соли жирных кислот. Перед тем как решиться применить тот или иной реставрационный материал (раствор, препарат), реставратор должен заинтересоваться степенью его кислотности или щелочности. Реакцию среды контролируют путем определения рН. В тех случаях, когда это возможно, производят реакцию нейтрализации. При обнаружении высокой активной кислотности — низкого рН — ее нейтрализуют щелочью (основанием). Гидроксильные ионы ОН- основания связывают водородные ионы Н+ с образованием воды Н++ОН __________ * Гидролиз клея выражается в разрушении межмолекулярных и молекулярных связей. 182 Перед реставрацией рН проверяется по изменению цвета индикатора, обычно по индикаторной бумаге. Бумагу смачивают свежепрокипяченной дистиллированной водой, прикладывают с помощью чистого пинцета к исследуемой поверхности и прижимают чистой стеклянной пластинкой.
ПРОЦЕССЫ УДАЛЕНИЯ ПОВЕРХНОСТНЫХ ЗАГРЯЗНЕНИЙ С ПРОИЗВЕДЕНИИ ЖИВОПИСИ И ПРИМЕНЯЕМЫЕ ПРИ ЭТОМ МАТЕРИАЛЫ
ДИСПЕРСНЫЕ СИСТЕМЫ
Кроме обычных (истинных) растворов, в которых частицы растворенного вещества достигают предельной дисперсности (раздробленности), то есть равны размерам молекул и ионов, в реставрационной практике находят широкое применение такие системы, отдельные частицы которых включают много сотен и тысяч атомов или молекул, имеют свою внутреннюю поверхность раздела со средой, в которой они распределены (но не растворены). Такие системы называются дисперсными системами. Раздробленные вещества называют дисперсной фазой, а среда, в которой распределена дисперсная фаза, носит название дисперсной среды. По степени дисперсности системы делятся на два класса: грубодисперсные (размер частиц от 10-3 до 10-5 см) и коллоиднодисперсные (размер частиц от 10-5 до 10-7 см). По агрегатному состоянию грубодисперсные системы делятся на суспензии, эмульсии, пены и аэрозоли. В суспензиях частицы твердой дисперсной фазы распределены в жидкой дисперсной среде. В эмульсиях мельчайшие капельки жидкой дисперсной фазы распределены в жидкой дисперсной среде. В пенах ячейки (пузырьки), наполненные воздухом или другим газом, отделены друг от друга жидкими пленками. В аэрозолях дисперсной средой является воздух или иной газ, а дисперсной фазой — капельки жидкости или диспергированное твердое вещество. Эмульсии. Их применение в реставрации живописи. Эмульсии находят применение при удалении загрязнений с поверхности живописи. В процессе расчистки масляной живописи используют следующие составы, дающие эмульсии: вода + пинен + масло (льняное очищенное) + спирт + аммиак (несколько капель нашатырного спирта), вода + масло (льняное) + аммиак (несколько капель нашатырного спирта); а для древней темперной живописи: вода + толуол + ОП-7 (1 часть на 7 частей воды); вода + спирт + подсолнечное масло + аммиак (несколько капель нашатырного спирта). Эмульсии также применяются для укрепления красочного слоя и в качестве связующих для темперных красок: природная эмульсия — яичный желток — и синтетические дисперсии на основе поливинилацетата, полиакрилатов и др. Различают эмульсии неполярной (или слабо полярной) жидкости в полярной (например, эмульсии масла в воде) — эмульсии первого рода — и эмульсии полярной жидкости в неполярной (например, эмульсия воды в масле) — эмульсии второго рода. Эмульсии первого рода часто обозначают через м/в, где под буквой «м» подразумевается масло или иная неполярная жидкость, а под буквой «в» — вода или иная полярная жидкость. Эмульсии второго рода обозначают соответственно через в/м. Применяемые для удаления загрязнений с поверхности живописи эмульсии масла, а также толуола в воде относятся к эмульсиям м/в; масло или толуол образуют дисперсную фазу, а вода — дисперсионную среду. В желт- 183 ке куриного яйца дисперсной фазой являются мельчайшие капельки липидов (жиров), дисперсионной средой — вода. В поливинилацетатной дисперсии частицы поливинилацетата являются дисперсной фазой, а вода — дисперсионной средой. Эмульсии получаются методом диспергирования двух несмешивающихся жидкостей. Диспергирование производят встряхиванием, взбалтыванием, разбиванием смеси в аппаратах различных конструкций. Взбалтывая, например, 5 мл растительного масла в 50 — 70 мл воды в закрытом цилиндре, получают эмульсию; при этом происходит разбивание масла на крошечные капельки, распределяющиеся в водной среде. Для придания эмульсии устойчивости, требуется ввести в систему третий компонент, понижающий поверхностное натяжение — поверхностно-активное вещество. Этот компонент называется эмульгатором. При малых концентрациях эмульсий можно повысить устойчивость системы, вводя какое-либо поверхностно-активное вещество, способное понизить поверхностное натяжение на поверхности раздела фаз. Например, добавлением бутилового спирта в систему вода — бензол можно несколько уменьшить скорость слияния капель раздробленного бензола. При больших концентрациях эмульсий взвешенные капли очень часто сталкиваются между собой, что приводит к их слиянию. Поэтому в концентрированных эмульсиях эмульгаторами могут быть те поверхностно-активные вещества, которые способны адсорбироваться на поверхности капелек и создавать на них прочную упругую пленку, предохраняющую их от слияния. Такие эмульгаторы сообщают эмульсии высокую устойчивость. Эмульсии м/в стабилизируются растворимыми в воде высокомолекулярными соединениями — белками (желатиной, казеином), поливиниловым спиртом, водорастворимыми мылами (например, натриевым мылом) и др. Эмульсии в/м стабилизируются высокомолекулярными соединениями, растворимыми в углеводородах или мылами кальция, магния. Применяемый при эмульгировании толуола в воде препарат ОП-7 является поверхностно-активным веществом. В яичном желтке эмульгатором системы м/в является лецитин. Высокая стабильность поливинилацетатной дисперсии обусловлена поливиниловым спиртом. В акрилатных эмульсиях эмульгатором служит некаль. В эмульсиях, применяемых для удаления загрязнений с произведений живописи, содержатся эмульгаторы — поверхностно-активные вещества. Последние способствуют смачиванию отмываемой поверхности и частиц загрязнений моющим составом, адсорбируются на поверхности частиц и тем самым препятствуют их слиянию и обратному прилипанию к отмываемой поверхности. В этих сложных системах, содержащих воду, органические растворители, масляную фазу и эмульгаторы, одни компоненты избирательно смачивают, а другие растворяют наиболее близкие им по полярности элементы поверхности и загрязняющие частицы. Моющее действие поверхностно-активных веществ. К моющим веществам относятся мыла и разнообразные сложные по составу синтетические препараты. Под мылами в узком смысле слова подразумевают соли одноосновных, сравнительно высокомолекулярных жирных кислот, обладающие поверхностной активностью. Их принято называть «обычными мылами». Из них особое значение имеют натриевые мыла пальмитиновой, стеариновой и ненасыщенной олеиновой кислот, получаемых из животных жиров. Обычные мыла содержат в себе большое коли- 184 чество воды, а часто и примеси различных веществ. Для произведений живописи опасна высокая щелочность многих мыл. Мыло туалетное, выпускаемое согласно МРТУ 18/236-68, представляет собой продукт механической обработки высококачественного ядрового мыла, состоящего, в основном, из натриевых солей жирных (натуральных и синтетических) кислот с добавлением краски и отдушки или без них. Мыло туалетное подразделяется на 80%-ное, детское, I, II и III группы. Из всех сортов туалетного мыла «детское мыло» выгодно отличается меньшим предельным содержанием свободной щелочи — 0,03% против 0,05% у остальных сортов. В первых трех сортах туалетного мыла допускаемое содержание свободной углекислой соды — 0,2%. (Только в «детское мыло» вводятся ланолин или спермацет — 1%, борная кислота — 0,5%.) Очень часто под мылами понимают все соединения, близкие к мылам по строению молекул и обладающие аналогичными физико-механическими и техническими свойствами. Иногда такие соединения называют также моющими веществами — детергентами. К моющим средствам, содержащим в качестве активной группы сульфо-группу, следует в первую очередь отнести соли высокомолекулярных сульфокислот. Сюда же относятся соли алкилзамещенных нафталинсульфокислот. Соединения последнего типа получили в технике название некалей. В качестве моющих средств в настоящее время широко применяют и алкилсульфаты — эфиры серной кислоты с высшими спиртами, а также их соли. Помимо мыл, молекулы которых диссоциируют (распадаются) на ионы, существуют так называемые неионные мыла, то есть моющие средства с молекулами, не способными к ионизации. Примером неионных моющих средств являются соединения, получаемые в результате взаимодействия молекулы высокомолекулярного спирта (или алкилфенола) с несколькими молекулами окиси этилена СnH2n+1(ОСН2СН2)m он (к этому типу мыл относится препарат ОП-7, применяемый при эмульгировании толуола в воде). В настоящее время известны сотни синтетических веществ, обладающих моющими свойствами. Растворы мыл относятся к полуколлоидным системам. Полуколлоидными называются системы, которые в одних условиях могут представлять собой истинные растворы, — то есть гомогенную систему, содержащую молекулы, а в других — дисперсную систему, частицы которой представляют собой объединение множества молекул. Такие частицы называются мицеллами. Они существуют до тех пор, пока в результате действия внешних факторов не сместится равновесие, в котором пребывала система. В системе, в которой образовались мицеллы, всегда продолжает существовать некоторое количество истинно растворенного вещества дисперсной фазы. С повышением содержания мыла в растворе в системе из отдельных молекул мыла начинает образовываться большое количество мицелл.
Сущность процесса удаления загрязнений с поверхности живописи с помощью растворов мыл. Моющее действие мыл связано с рядом различных эффектов. В присутствии в воде поверхностно-активного мыла понижается поверхностное натяжение на границе вода — очищаемая поверхность и улучшается смачивание этой поверхности моющей жидкостью. Это способствует проникновению жидкости в такие капилляры загрязненной поверхности, такие щели и трещины слипшихся грязевых частиц, в которые 185 чистая вода проникнуть не может. Молекулы мыла адсорбируются на отмываемой поверхности и частицах твердых и жидких загрязнений, создают на них хорошо гидратированный адсорбционный слой. Все это способствует отрыву частиц загрязнений от поверхности и раздроблению их на мельчайшие отдельные частицы (с образованием эмульсий или суспензий). Адсорбционные пленки на поверхности частиц загрязнений придают этим частицам высокую агрегативную устойчивость, предохраняют их от слипания и не допускают прилипания их к отмываемой поверхности. Моющее действие в известной степени связано со способностью загрязнений, особенно если они имеют масляный характер, коллоидно растворяться (солюбилизироваться) в мыльных растворах. Солюбилизация представляет собой растворение органических веществ в углеводородной части мицелл, всегда присутствующих в достаточно концентрированных растворах мыл. Количество коллоидно растворенного органического вещества, как правило, возрастает с увеличением молекулярного веса мыла. Количество солюбилизированного вещества зависит от концентрации мыльного раствора. После отмывки поверхности от загрязнений необходимо тщательно удалить промывкой остатки мыл, так как, оставаясь адсорбированными на отмытой поверхности, они с течением времени могут отрицательно влиять на сохранность живописи.
МАТЕРИАЛЫ, ПРИМЕНЯЕМЫЕ ДЛЯ УДАЛЕНИЯ ЛАКОВЫХ ПОКРЫТИЙ И РАСЧИСТКИ ЖИВОПИСИ
В живописи широко используются органические растворители. Они применяются для приготовления покрывных лаков, разбавления разжижения масляных красок, промывки картин, удаления постаревших защитных лаковых покрытий и для удаления записей. В распоряжении реставраторов имеются многочисленные растворители или их смеси, которые используются для вышеуказанных целей. Во всех случаях использования органических растворителей приходится считаться со множеством факторов, обусловленных взаимодействием растворителей с материалами произведений, влиянием на человека (токсичностью), требованиями техники безопасности. Многие органические растворители действуют на белковые клеи (желатину, рыбий клей, белок куриного яйца) денатурирующим образом (понижая их растворимость в воде), вызывают сильное набухание линоксина*, анекоторые (тетралин, циклогексанол) способны его растворять. Особая осторожность нужна при удалении старой олифы и масляных записей с произведений древней темперной живописи, так как лецитин яичного желтка, являющегося связующим веществом темперных красок, хорошо растворим во многих органических растворителях (хлороформе, бензоле, этиловом эфире, этиловом спирте и др.).
ОСНОВНЫЕ ХАРАКТЕРНЫЕ ПОКАЗАТЕЛИ ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЕЙ
Каждый растворитель характеризуется температурой кипения, летучестью, степенью огнеопасности, токсичности, что необходимо учитывать при подборе растворителей и работе с ними. __________ * Линоксином называют твердые трехмерные нерастворимые и неплавкие полимеры, являющиеся конечным продуктом при «высыхании» масла. Такие масла, как льняное, ореховое, маковое, весьма быстро образуют твердую пленку. Масла этого типа называются «высыхающими». По мере «высыхания» масляной пленки происходит понижение ее растворимости в органических растворителях. 186 Температура кипения и перегонка (дистилляция) растворителей.Каждая жидкость кипит при вполне определенной постоянной температуре, зависящей от внешнего давления. Обычно имеют в виду температуру, при которой жидкость кипит, находясь поднормальным давлением (одна атмосфера или 760 мм ртутного столба). Температурой кипения называется температура, при которой давление пара жидкости становится равным внешнему давлению. Когда кипение началось, повышение температуры жидкости прекращается, несмотря на то, что нагревание продолжается. Если жидкость нагревать до кипения и отводить образующиеся пары по трубке, то при их охлаждении на стенках начнется образование капель — конденсация паров. Этим свойством жидкости пользуются для очистки растворителей перегонкой (дистилляцией). Для этой цели служит прибор, состоящий из круглодонной колбы с отводной трубкой, термометра, холодильника и приемника. Воду, очищенную от растворенных в ней примесей перегонкой, называют дистиллированной*. Когда из смеси растворителей с различными температурами кипения требуется выделить некоторые компоненты, тогда применяют дробную перегонку. При этом в горло колбы с отгоняемой жидкостью вставляется дефлегматор, снабженный термометром. Дробной перегонкой, например, получают головные отгоны скипидара; более тяжелые фракции и нелетучая часть остаются в колбе.
Летучесть растворителей.Удаление растворителей без повышения температуры путем испарения в токе воздуха называется летучестью. Летучесть определяется величиной молекулярного веса растворителя и другими фактора- __________ * Для перегонки волы пользуются специальными дистилляторами. ми, в первую очередь его полярностью. Молекулы полярных растворителей в значительной степени ассоциированы, что является причиной относительно малой упругости пара и, следовательно, высокой температуры кипения и малой летучести. Упругость пара (давление, оказываемое паром, находящимся в равновесии с жидкой или твердой фазой) в определенной степени характеризует летучесть ряда растворителей, например, у этилового спирта при 20° упругость пара 44 мм рт. ст., а у этилового (серного) эфира 442,4 мм рт. ст. Если принять скорость улетучивания капли этилового эфира за 100, то относительная скорость улетучивания этилового спирта будет равна 12 (см. табл. 11). Летучесть зависит и от величины скрытой теплоты испарения, теплоемкости, теплопроводности и других свойств жидкости. Так, этиловый спирт (температура кипения 78,3°) и вода (100°) улетучиваются при комнатной температуре медленнее, чем толуол (110°). Температуры кипения монометилового эфира этиленгликоля (метилцеллозольва) и бутилацетата очень близки друг к другу (около 125°), но летучесть последнего примерно в 3 раза больше.
Огнеопасность растворителей.К огнеопасным растворителям относятся этиловый (серный) эфир, этиловый спирт, ацетон, сероуглерод, бензол, бензин, петролейный эфир и др. Менее горючими являются растворители группы хлоропроизводных. Для количественной оценки огнеопасности горючих жидкостей пользуются двумя характеристиками: температурой воспламенения и температурой вспышки. Температурой воспламенения называют температуру, при которой поверхность растворителя при кратковременном приближении пламени загорается и продолжает гореть. 187 Таблица 11 Температура кипения некоторых растворителей и величины, характеризующие их относительную летучесть.
Температурой вспышки называют температуру, при которой наблюдается первая вспышка паров растворителя при приближении пламени. Это та минимальная температура, при которой пары горючих жидкостей, образуя с воздухом взрывчатую смесь, дают вспышку при приближении огня. Особенно огнеопасным является этиловый (серный) эфир, он образует с воздухом взрывоопасные смеси при содержании его в воздухе от 1,85 до 36,5%. При наличии в воздухе взрывоопасной смеси паров эфира может возникнуть вспышка при наличии огня даже на расстоянии 3 — 5 м. (Взрывоопасные концентрации характеризуются минимальной концентрацией паров, при которой уже возможно воспламенение, и максимальной.)
Токсичность растворителей.Большинство органических растворителей вредно действует на человеческий организм. Реставраторы, применяющие ор- __________ * Летучесть устанавливается путем определения длительности испарения 0,5 мл жидкости, нанесенной на фильтровальную бумагу, причем летучесть этилового эфира принята за 100. ганические растворители, должнызнать степень токсичности, а также летучести каждого из них, использовать индивидуальные защитные приспособления при работе с ними, принимать необходимые меры предупреждения отравления*. Мерами, предупреждающими отравление, являются общая вентиляция помещения и использование местных вентиляционных устройств — вытяжных шкафов иместных вытяжек; индивидуальными средствами защиты служат респираторы ифильтрующие противогазы (применяются в особых случаях)**. Каждый растворитель характеризуется предельно допустимой концентрацией ввоздухе и миллиграммах налитр воздуха.
НАИБОЛЕЕ ПРИМЕНЯЕМЫЕ РАСТВОРИТЕЛИ. ОСНОВНЫЕ СВОЙСТВА
Скипидар (терпентинное масло) и пинен.Скипидар применяется как растворитель для смол, жиров (масел), __________ * Содержание паров растворителя в воздухе контролируется санитарно-эпидемиологическими станциями. ** Соблюдение осторожности необходимо не только при работе с летучими растворителями, но и при их хранении. 188 восков, как разжижитель для масляных красок и лаков, а в реставрации — при удалении старых лаковых пленок. Скипидар, или терпентинное масло, получают из естественной смолы хвойных деревьев, главным образом сосны. Смолу, вытекающую из насечек на стволе дерева, называют живицей, а в высохшем состоянии — серой. При перегонке смолы с парами воды отгоняется жидкий скипидар — живичный, или серный,— и остается твердая смола — канифоль. Этот сорт скипидара является наиболее ценным и применяется для живописи. Промышленность выпускает несколько сортов скипидара. Скипидар — сложная смесь, главной составной частью которой является терпеновый углеводород ά— пинен. Его содержание достигает в так называемом «русском» скипидаре 60 — 70%. Терпенами называют непредельные углеводороды состава C10H16. Пинен имеет одну двойную (ненасыщенную) связь. В неочищенном или плохо очищенном виде скипидар содержит примесь фенолов, альдегидов, сложных эфиров, фурана и его производных, аллиловых соединений и т. п. Примеси удаляются обработкой скипидара щелочью и серной кислотой. Очищенный скипидар — бесцветная или зеленовато-желтая жидкость со специфическим запахом. Упругость пара 4,45 мм* при 20° и 10,8 мм при 40°. При 0,73%-ном содержании в воздухе скипидар взрывается от пламени. Температура вспышки скипидара разного происхождения колеблется от 32 до 42°. Действие скипидара на организм заключается в следующем: при концентрации 4 — 5 мг/л «щиплет» глаза, наблюдается головокружение, голов- __________ * Упругость пара выражается в мм ртутного столба. ная боль, тошнота, учащение пульса. Концентрация 0,7 — 1 мг/л вызывает в течение 15 минут у большинства людей раздражение слизистой оболочки глаз, горла, носа. Предельно допустимая концентрация 0,3 мг/л. Действует на кожу воспаляюще, особенно старый скипидар. Скипидар легко смешивается с большинством растворителей (бензином, бензолом, сероуглеродом, хлорированными углеводородами и др.). Хорошо растворяется в ацетоне, абсолютном этиловом спирте, не растворяется в воде. Растворимость в разбавленном спирте зависит в значительной степени от возраста скипидара и крепости спирта. Скипидар является отличным растворителем разнообразных смол, жиров, металлических солей жирных и смоляных кислот, лаков, каучука. Шеллак и ископаемые смолы в скипидаре не растворяются. При действии света и воздуха скипидар легко окисляется (особенно в нагретом состоянии), приобретает желтый цвет и своеобразный запах. При этом удельный вес его, показатель преломления и кислотное число повышаются. При окислении скипидара образуются соединения типа перекисей, которые со временем, а особенно при нагревании, снова отщепляют кислород, благодаря чему скипидар действует как окислитель. Окисляющее действие скипидара очень ценно при употреблении его в качестве растворителя или разбавителя для масляных лаков и красок, так как способствует более быстрому и равномерному «высыханию» масла после нанесения его на поверхность. Скипидар способен до некоторой степени размягчать ранее нанесенные слои краски или лака, благодаря чему у последних получаются более прочные и однородные пленки. В смеси с другими растворителями (например, спиртом, бензином) скипидар используется для удаления лако- 189 вых пленок и записей с произведений масляной живописи. Скипидар обладает антисептическими свойствами. Прежде чем пользоваться скипидаром, его проверяют на чистоту: капля скипидара, нанесенная на фильтровальную бумагу, должна испариться в течение нескольких минут без остатка. Если же скипидар оставляет на бумаге пятна, то это значит, что он содержит нелетучие смолистые остатки. Такой скипидар непригоден для живописных и реставрационных целей. Допустимо использование головных летучих фракций, получаемых при дистилляции такого скипидара. Для разбавления художественных масляных красок и лаков, расчистки картин и снятия старых лаковых покрытий лучше пользоваться пиненом, являющимся фракцией скипидара, получаемой отделением (перегонкой) от тяжелой, наиболее осмоляемой части скипидара. Ленинградским заводом художественных красок выпускается пиненовая фракция живичного скипидара, под названием «Пинен (разбавитель № 4) для живописи». Он менее подвержен осмолению и пожелтению, чем обычный скипидар. Его рекомендуют хранить в плотно закрытых флаконах в темном неогнеопасном помещении; внутри флаконов не должен оставаться воздух. Гарантийный срок хранения — 6 месяцев. Живичный скипидар в смеси с уайт-спиритом 1:1 выпускается Ленинградским заводом художественных красок под названием «разбавитель № 1». Он применяется для разбавления эскизных масляных красок, рельефных паст и для вспомогательных целей. При длительном соприкосновении с воздухом может желтеть.
Растворители класса спиртов. В живописи и реставрационной практике в качестве растворителей применяются предельные (насыщенные) одноатомные спирты: метиловый, этиловый, пропиловые, бутиловые, амиловые. Двухатомные и трехатомные спирты применяются главным образом в качестве пластификаторов — этиленгликоль, глицерин. Кроме указанных ациклических спиртов находят применение также спирты циклического строения, например циклогексанол (см. табл. 12, 13).
Растворители классов эфиров и производных спиртов.В качестве растворителей находят значительное применение эфиры и производные спиртов. Применяются простой эфир этилового спирта — этиловый (серный) эфир, простые эфиры этиленгликоля — диоксан, этилцеллозольв и метилцеллозольв, производное этиленгликоля — формальгликоль. Находят применение также сложные эфиры этилового спирта — этилацетат, бутилового спирта — бутилацетат, амилового спирта — амилацетат (см. табл. 12 и 13).
Растворители класса кетонов.В реставрации применяют кетоны: ацетон, метилэтилкетон, циклогексанон, метил-циклогексанон. Кетоны — соединения, содержащие карбонильную (кето-группу) —СО—, связанную с двумя углеводородными радикалами: R—СО—R. Первые два кетона относятся к алифатическому (жирному) ряду. Кетоны, в которых карбонильная группа входит в кольцо, называются циклическими; к ним относятся последние два кетона. Низшие (небольшого молекулярного веса) алифатические (нециклические) кетоны — подвижные, бесцветные летучие жидкости с приятным запахом, смешивающиеся с водой (см. табл. 12 и 13).
Бензины. Бензины — это сложные смеси углеводородов. Они являются растворителями и экстрагентами, представляющими собой узкие низкокипящие фракции прямой перегонки нефти. 190 Одним из важных их свойств является скорость улетучивания. Бензин экстракционный ГОСТ 462-51 имеет началом кипения температуру 70°, причем не менее 98% должно перегоняться до 95°. Этот бензин применяется в технике для получения быстросохнущих лаков и красок. Содержание ароматических углеводородов (бензол, толуол) не выше 4%. Не содержит водорастворимых кислот и щелочей. Бензин — растворитель для лаков и олиф в лакокрасочной промышленности (уайт-спирит) ГОСТ 3134-52 характеризуется высокой температурой начала кипения (не выше 165°); 98% уайт-спирита перегоняется при нагревании до 200°; не содержит водорастворимых кислот и щелочей; содержание ароматических углеводородов не более 16%. В бензинах прямой перегонки нефти не содержится непредельных (ненасыщенных) углеводородов, вследствие этого бензина эти обладают высокой химической стабильностью и не осмоляются при хранении. Наряду с бензинами нефтяного происхождения ограниченное применение находят бензины искусственные и синтетические. Взрывоопасная концентрация бензина в воздухе составляет 2,9 — 8,1% (неодинакова для разных бензинов). Температура вспышки, как правило, ниже 0°. Токсическое действие. Отравления возможны при переливании и чистке одежды в небольших помещениях. Оказывают наркотическое действие. В случае высокого содержания бензола и его гомологов — бензин при хроническом отравлении действует на кроветворные органы. Предельно допустимая концентрация для бензинов-растворителей — 0,3 мг/л, для бензина топливного (получаемого крекингом) — 0,1 мг/л. Бензин смешивается сбольшинством органических растворителей. Он растворяет частично даммару (суматра) и почти полностью остальные виды даммары; хорошо растворяет воски, частично или полностью — канифоль. В бензине растворяются также жирные кислоты льняного масла и эфирные масла. Уайт-спирит в смеси со скипидаром или пиненом применяется для разбавления масляных красок (разбавитель № 1 Ленинградской фабрики художественных красок). В ряде случаев бензин находит применение для промывки масляной живописи при соблюдении достаточной осторожности.
Растворители класса ароматических углеводородов. Наиболее важными представителями этого класса являются бензол и его производные — толуол, ксилол. Все они содержат ту же кольчатую группировку, которая имеется в бензоле и называется «бензольным, или ароматическим, ядром» (см. табл. 12 и 13).
Растворители класса хлоропроизводных углеводородов.Наиболее важными представителями являются хлористый метилен, хлороформ, четыреххлористый углерод, дихлорэтан (см. табл. 12 и 13).
КЛЕИ, СВЯЗУЮЩИЕ, ПЛАСТИФИКАТОРЫ И ПЛЕНКООБРАЗУЮЩИЕ, ПРИМЕНЯЕМЫЕ ПРИ РЕСТАВРАЦИИ ЖИВОПИСИ
При дублировании живописи на холсте, укреплении грунта и красочного слоя произведений темперной и масляной живописи, а также при других реставрационных работах используются многие природные, синтетические и искусственные высокомолекулярные соединения. 191 Таблица 12 Специфические особенности, область применения и токсичность некоторых органических растворителей
192 Таблица 12 (продолжение)
193 Таблица 31. Свойства некоторых органических растворителей
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
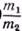 . Например, для приготовления 5%-ного раствора клея готовят раствор с таким расчетом, чтобы в 100 г раствора содержалось 5 г клея и 95 г воды. (В производственных условиях часто пользуются растворами, концентрация которых выражается количеством граммов вещества, растворенного в 100 миллилитрах (мл) растворителя.) Часто удобно вместо веса (m) растворителя отмерить его объем v. Если плотность (d)* растворителя известна, вычисляют объем v по формуле v=
. Например, для приготовления 5%-ного раствора клея готовят раствор с таким расчетом, чтобы в 100 г раствора содержалось 5 г клея и 95 г воды. (В производственных условиях часто пользуются растворами, концентрация которых выражается количеством граммов вещества, растворенного в 100 миллилитрах (мл) растворителя.) Часто удобно вместо веса (m) растворителя отмерить его объем v. Если плотность (d)* растворителя известна, вычисляют объем v по формуле v= 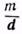 . Например, для приготовления 5%-ного раствора смолы в скипидаре (плотность 0,85) растворяют 5 г смолы в
. Например, для приготовления 5%-ного раствора смолы в скипидаре (плотность 0,85) растворяют 5 г смолы в  = 111,7 мл скипидара. Для приготовления водных растворов отмеривают количество мл воды, равное весовому количеству в граммах (принимая массу 1 мл воды за 1 г).
= 111,7 мл скипидара. Для приготовления водных растворов отмеривают количество мл воды, равное весовому количеству в граммах (принимая массу 1 мл воды за 1 г).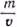 . Единица плотности в международной системе — кг/м3. Единицей плотности в лабораторной практике принята считать г/см3. Она с точностью до пятого знака может быть выражена через г/мл, так как 1 мл = 1,000028 см3. Плотность жидкости зависит от температуры.
. Единица плотности в международной системе — кг/м3. Единицей плотности в лабораторной практике принята считать г/см3. Она с точностью до пятого знака может быть выражена через г/мл, так как 1 мл = 1,000028 см3. Плотность жидкости зависит от температуры.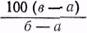
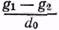
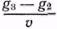
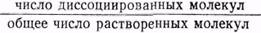
 СН3СОО-+Н+*
СН3СОО-+Н+*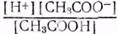
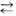 H++OH-. Диссоциация воды — это обратимый процесс, для нее можно записать выражение константы диссоциации: К=
H++OH-. Диссоциация воды — это обратимый процесс, для нее можно записать выражение константы диссоциации: К= 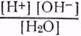 . (1) где [H+] — концентрация ионов водорода, г-ион/л [ОН-] — концентрация ионов гидроксила, г-ион/л [H2O] — количество молей воды в 1 л.
. (1) где [H+] — концентрация ионов водорода, г-ион/л [ОН-] — концентрация ионов гидроксила, г-ион/л [H2O] — количество молей воды в 1 л.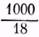 = 55.56 молей воды в одном литре ее. [Н+].[ОН-]=1,8.10-16[55,56]=10-14 (при 22o).
= 55.56 молей воды в одном литре ее. [Н+].[ОН-]=1,8.10-16[55,56]=10-14 (при 22o). Н2О. При обнаружении значительной активной щелочности — высокого содержания гидроксильных ионов, то есть высокого значения рН — производят реакцию нейтрализации кислотой ОН-+H+
Н2О. При обнаружении значительной активной щелочности — высокого содержания гидроксильных ионов, то есть высокого значения рН — производят реакцию нейтрализации кислотой ОН-+H+