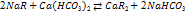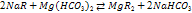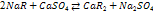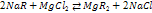Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Иониты (катиониты и аниониты), их природа, строение, свойства.По характеру своего действия ионообменные вещества подразделяются на катиониты и аниониты. В-ва, обменивающие катионы, наз катионитами, а обменивающие анионы — анионитами. Катиониты диссоциируют на неб, подвижные и способные к ионному обмену катионы (например, Н+) и высокомолекулярный анион (Rm-1), а аниониты дают мелкие, легко перемещающиеся анионы (например, ОН-) и высокомолекулярный катион (Rn+).Катиониты со смешанными функциональными группами встречаются в следующем сочетании: 1) сульфокислые и оксифенольные; 2) сульфокислые и карбоксильные; 3) остатки фосфорной кислоты и оксифенольные; 4) мышьяковокислые и оксифенольные; 5) карбоксильные и оксифенольные.Сильнокислотные катиониты вступают в реакцию ионного обмена с растворенными в воде солями в нейтральной и кислой средах (сульфо- и фосфорнокислые катиониты). Слабокислотные катиониты, содержащие карбоксильные или оксифенольные группы, обменивают свой протон в нейтральных р-рах лишь на катиониты солей слабых кислот, причем полнота обмена возрастает с повышением рН среды. След-но, большинство катионитов представляют собой полимерные полифункциональные кислоты, в состав которых входят группы -СООН, - S03H, -ОН, -SH, SiOOH и др.В практике очистки воды часто используют Н- и Na-катиониты. В зависимости от катиона и наз этот процесс Н-катионирование и Na -катионирование. При Н-катионировании повыш кислотность воды, а при Na-катионировании происходит увеличщелочности фильтрата, если в исходной воде содержится карбонатная жесткость.Аниониты явл высокомолекулярными соединениями, содержащими огромное количество основных групп, таких, как —NH2, —NH3OH, —NHR, —NR2 и т. д. В состав одного и того же ионита могут входить ионогенные группы с различной степенью кислотности и щелочности. Смоляные аниониты с одинаковыми ионогенными группами следующие: 1) четвертичные аммониевые основания; 2) третичные амины; 3) вторичные амины; 4) первичные амины; 5) четвертичные сульфониевые основания.  Смоляные аниониты с разнотипными ионогенными группами содержат аминогруппы с различной степенью замещения.Сильные аниониты вступают в реакцию с р-рами солей в нейтральной и даже слабощелочной среде. Слабоосновные аниониты вступают в реакцию обмена лишь в кислых средах, причем полнота обмена гидроксильной группы анионита на анион растворенного электролита возрастает с повышением кислотности среды.При катионировании происходят следующие процессы:
Термический метод умягчения воды. При нагревании воды до кипения происходит превращение гидрокарбонатов кальция и магния в карбонаты по следующим схемам: Са (НСО3)2↔СаСО3 ↓+ СО2 + Н2О Мg (НСО3)2↔МgСО3 + СО2 + Н2О Эти обратимые процессы можно почти целиком сместить вправо за счет кипячения воды, так как при высоких температурах растворимость двуокиси углерода понижается. Однако полностью устранить карбонатную жесткость нельзя, так как углекислый кальций хотя и незначительно (около 9,95 мг/л при 15°С), но растворим в воде. Растворимость МgС03 достаточно высока (110 мг/л), поэтому при длительном кипячении он гидролизуется с образовмалорастворимой (8 мг/л) гидроокиси магния: МgСО3 + Н2O ↔Mg(OH)2↓+ СО2 Кипячением частично устраняется сульфатная жесткость, так как растворимость сульфата кальция падает с увеличением темп. Этот метод может применяться для умягчения воды, содержащей преимущественно карбонатную жесткость и идущей для питания котлов низкого и среднего давления. ИМПФИРОВАНИЕ (ПОДКИСЛЕНИЕ)Процесс перевода карбонатной жесткости в некарбонатную путем добавления к воде минеральной кислоты называется импфированием Многие производства требуют отсутствия в воде карбонатной жесткости и допускают при этом наличие некарбонатной. Например, из жесткой воды, идущей для охлаждения, при большом температурном перепаде на стенках аппаратуры может отлагаться карбонат кальция. Импфирование осуществляется добавкой к воде соляной или серной кислоты в количествах, эквивалентных карбонатной жесткости. При этом протекают реакции Са(НСО3)2 + 2НСl↔СаСl2 + 2Н2О + 2СО2 Mg(НСО3)2 + Н2SО4↔МgSО4 + 2Н20 + 2СО2 Метод подкисления удобен тем, что он не требует громоздкого реагентного хозяйства, химическая реакция протекает быстро и отсутствуют осадки. К недостаткам этого процесса относятся высокая стоимость и необходимость тщательного контроля за добавкой кислоты. Контроль удобно осуществлять автоматически измерением электропроводности воды, увеличение которой говорит о наличии свободной кислоты. ОПРЕСНЕНИЕ ВОДЫ Процесс удал из воды солей называется обессоливанием, или опреснением. При обессоливании удалсоли почти полностью, а при опреснении до остаточной концентрации их 1000 мг/л. Для удалсолей из воды существует несколько методов: 1) дистилляция и вымораживание воды; 2) электрохимич метод; 3) метод ионного обмена. Дистилляция и вымораживание. При дистилляции воду нагревают до кипения, пары проходят через холодильник, конденсируются и дистиллят собирается в приемник. Этим способом можно освободиться от растворенных нелетучих веществ. При вымораживании растворенных солей пользуются тем, что при замерзании концентрированных растворов первые порции льда состоят из чистого растворителя с малыми включениями растворимых солей, которые при повышении темп плавятся первыми. Электрохимический метод. Этот метод обессоливания воды основан на использовании электродиализа и электроосмоса.Принцип опреснения воды электрохимическим способом основан на электролизе находящихся в ней солей при пропускании электрического тока. При этом на аноде протекает процесс окисления анионов, а на катоде — восстановления катионов. Катодное и анодное пространства изолируются от основного потока диафрагмами.Анодной диафрагмой служит керамика или микропористая резина, катодной — асбестовая ткань. В анодную камеру погружают электрод из магнетита Fe3O4, в катодную — из железа, цинка или стали.В централ камеру подается вода, подлежащая очистке. При вкл тока ионы прониксквозь диафрагмы в катодное и анодное пространства. Обратная диффузия их затруднена диафрагмами. Аппарат для опреснения воды состоит из десяти последовательно соединенных ячеек. Вода последов проходит через них, подвергаясь все большему и большему опреснению. Напряжение между электродами первой ячейки поддерживается низкое. В последующих ячейках оно постепенно увеличивается, достигая напряжения постоянного тока в сети (110—120 В). В зависимости от загрязнения воды затрата электроэнергии составляет от 1,5 до 4,5 кВт-ч на 100 л очищенной воды. Трехкамерная ячейка не пригодна для очистки жестких вод, так как диафрагмы забиваются карбонатом кальция, что приводит к закупорке пор, которые приходится часто очищать кислотой. Наиболее сильное загрязнение диафрагм наблюдается в первой ячейке. Для устранения этого затруднения предложено раздельное выделение двухвалентных и одновалентных ионов. В первых ячейках удаляются из воды лишь анионы, а двухвалентные катионы выпадают в виде труднорастворимых солей в связи с происходящим уменьшением концентрации водородных ионов. В этом случае ячейки состоят из двух камер, разделенных лишь одной диафрагмой. Подача воды производится в катодное пространство, где выпадают в осадок многовалентные катионы. Затем освобождаются от щелочных металлов в трехкамерных ячейках. Установленные в них диафрагмы загрязняются значительно меньше.При погружении диафрагм в воду происходит диссоциация ионитов с переходом обменных ионов в раствор:RNa↔Nа+ + R–; RОН↔ОН– + R+ Анионитовая диафрагма заряжается положительно, а катионитовая отрицательно.Внедрение ионитовых диафрагм позволило устранить дуффузионные процессы и увеличить выход обессоленной воды при работе электрохимических установок. Этим методом можно обессоливать высокоминерализованные воды (даже морскую, содержащую до 30 г/л солей). Ионообменный метод. Этот метод обессоливания сводится к фильтрованию воды через Н– и ОН– ионитовые фильтры. При этом протекают следующие процессы: НR + NaCl ↔NaR + НС1; RОН + НС1↔Н20 + RС1или 2НR + Са(НСО3)2 ↔ СаR2+ 2Н2С03 Н2СО3↔Н2О + СО2 Углекислоту удал дегазацией, продувая через воду воздух, или разбрызгиванием в градирнях.Регенерация Н-катионитовой загрузки производится 1—1,5%-ным раствором Н2S04 или 3—7%-ным раствором НСl; регенерация анионитовых фильтров ROH осуществляется 4-5 %-ным раствором NaOH или NaHCO3. Этим методом можно довести обессоливание до 10-15 мг\л остаточных солей. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 502. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |