
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Условия фазового и химического равновесия. Правило фаз ГиббсаСтр 1 из 4Следующая ⇒ Билет 5 Тепловой эффект изохорных и изобарных процессов Существуют такие процессы, в ходе протекания которых остаются неизменными только один или несколько параметров системы, а все остальные меняются. Так, процесс, протекающий при постоянной температуре, называется изотермическим, при постоянном давлении – изобарным, а при постоянном объеме – изохорным. Если неизменными остаются температура и давление или температура и объем, то такие процессы называются, соответственно, изобарно-изотермическими или изохорно-изотермическими. Так, например, химические реакции, протекающие в живых организмах, являются изобарно-изотермическими. Большинство реакций, применяемых для промышленных и технических целей, осуществляется в условиях практически постоянного давления, т.е. является изобарными. Примерами изохорных реакций могут быть реакции, идущие в закрытом сосуде, реакции между твердыми телами и жидкостями без образования газа, реакции между газами, при протекании которых число молекул газа остается постоянным: Н2(г)+Cl2(г)= 2НCl(г). В изохорных процессах вся теплота, сообщенная системе или выделенная ею, определяется изменением внутренней энергии системы U2–U1= ΔU, где U1 – внутренняя энергия начального состояния системы; U2 – внутренняя энергия конечного состояния системы. В изобарных процессах для поддержания давления постоянным приходится изменять объем системы, т.е. увеличивать или уменьшать ее размеры (рис. 7). Говоря другими словами – совершать работу, которая определяется по формуле: А = р · S·h= р ·DV, где р – давление системы; ΔV – изменение объема системы (V2 – V1). 
Рис. 7. К пояснению физического смысла энтальпии В связи с этим в изобарных процессах выделяющуюся или затраченную теплоту нельзя определить только изменением внутренней энергии системы, нужно учесть совершенную работу, которая также эквивалентна определенному количеству энергии. В связи с этим в термодинамике используют новую величину – энтальпиюилитеплосодержание системы Н, определяемую соотношением: Н = U+ рV Энтальпия больше внутренней энергии на величину работы расширения, совершенной при изменении объема системы от 0 до V. Как и внутренняя энергия, энтальпия является функцией состояния и определить ее абсолютное значение нельзя. Можно только измерить изменение ΔН при переходе системы из одного состояния в другое: ΔН = Н2– Н1= (U2+рV2) – (U1+ рV1) =U2–U1+ (рV2– рV1) = ΔU+ р(V2–V1) = ΔU+ рΔV Протекание химических реакций сопровождается выделением или поглощением теплоты, которую можно измерить. Это количество теплоты называется тепловым эффектом химической реакции. Химические реакции, в которых происходит выделение теплоты, называются экзотермическими. Реакции, при протекании которых наблюдается поглощение теплоты, называютсяэндотермическими. Для реакций, протекающих при постоянном объеме, тепловой эффект (QV) равен изменению внутренней энергии системы: QV=U2–U1= ΔU Для реакций, протекающих при постоянном давлении, тепловой эффект (QР) равен изменению энтальпии системы: QР= Н2– Н1= ΔН = ΔU+ А при этомDU=QP–A Разница между величинами QVиQРможет быть достаточно велика для систем, содержащих компоненты в газообразном состоянии. Причем, если в ходе реакции химическое количество газообразных веществ возрастает N2O3 (г)→NO(г)+NO2 (г), то QVбудет больше, чемQР, на величину работы расширения против внешних сил, которую нужно совершить системой, чтобы давление в ней осталось неизменным. На совершение данной работы необходимо затратить определенное количество выделившейся теплоты. Величина этой работы, а значит, и разница между QVиQР, определяется соотношением: QV–QР= рΔV= ΔnRT где Δn – разность между числом молей газа в конечном и исходном состоянии; R – универсальная газовая постоянная; Т – температура системы. Для реакций, сопровождающихся уменьшением химического количества газов 2No(г)+o2 (г)= 2no2 (г), наоборот, QРбудет больше, чемQV, но теперь уже на величину работы сжатия системы, выполняемую внешней средой. При совершении ее выделится дополнительное количество энергии: QР–QV= ΔnRT Если же в ходе протекания реакции химическое количество газообразных веществ не меняется Н2(г)+Cl2(г)= 2НCl(г), то QV=QР. Для реакций, в которых участвуют только жидкие и(или) твердые вещества, различием в QVиQРможно пренебречь, т.к. объем жидкостей и твердых тел при нагревании или охлаждении изменяется незначительно.
Условия фазового и химического равновесия. Правило фаз Гиббса Фаза - совокупность однородных частей системы, одинаковых во всех точках по составу, физическим и химическим свойствам и имеющих видимые границы раздела. Фазовое равновесие подразумевает одновременное сосуществование двух или более фаз. Оно осуществляется путем непрерывного обмена частицами между этими фазами, т. е. фазовое равновесие имеет динамический характер, а именно: число частиц, перешедших из одной фазы в другую за единицу времени, в среднем равняется числу частиц, совершивших обратный переход. Условия фазового равновесия представляют собой математическую формулировку соотношений между физическими величинами, обеспечивающих существование нескольких фаз в многокомпонентной системе в отсутствие химических реакций. Для их вывода будем рассматривать интересующую нас многофазную систему вместе с внешней средой как замкнутую систему, условием равновесия которой является максимум суммарной энтропии, что записано в виде соотношения (2.8). В отличие от обозначений, ранее использованных в п. 2.2, номер фазы будем отмечать верхними римскими цифрами I, II,..., сохраняя нижние арабские цифры 1, 2,... для обозначения номера компонента. В применении к конкретным физическим условиям римские цифры будут при необходимости заменяться буквами, явно указывающими состояние вещества: г - газообразное, п - парообразное, ж - жидкое, т - твердое и к - конденсированное (жидкое или твердое). Рассмотрим две многокомпонентные фазы, содержащие К компонентов и составляющие замкнутую систему, для которой
приравненный нулю в соответствии с условием равновесия (2.8). В силу произвольности независимых приращений
Постоянство температуры Т и давления Р во всех равновесных фазах, выражаемое равенствами (4.8) и (4.9), отражает соответственно равновесие теплового и механического контактов между этими фазами (см. п. 2.3). Из равенств (4.10) следует, что для равновесия материального контакта химический потенциал каждого компонента должен быть одинаковым во всех фазах. В противном случае, как было показано в п. 3.2, возникает массоперенос вещества из фазы с большим химическим потенциалом в фазу с меньшим его значением. Условия материального равновесия (4.10) справедливы для частиц, не имеющих электрического, заряда. Химическое равновесие подразумевает равновесие химических реакций в системах с активными компонентами. Реакции, протекающие в одной фазе (газовой, жидкой или твердой), называются гомогенными реакциями (соответственно, газофазными, жидкофазными или твердофазными). Если участники реакции родятся в разных фазах, то химическая реакция является гетерогенной. Для обратимой химической реакции равновесие имеет динамический характер: число элементарных актов химического взаимодействия в реакции, идущей слева направо, среднем за единицу времени равняется числу элементарных актов в обратном направлении. Условие химического равновесия обеспечивает неизменный состав сосуществующих многокомпонентных фаз при протекании гомогенных или гетерогенных химических реакций. Так как условия равновесия фаз, выражаемые равенствами (4.8) и (4.9), являются изобарно-изотермическими, то системы с химическими реакциями следует описывать с помощью свободной энергии Гиббса Пусть в системе протекает обратимая химическая реакция, записанная по аналогии с (2.27) в обобщенной форме
Здесь химические компоненты Ан и Ак (стоящие со своими стехиометрическими коэффициентами Изобарным потенциалом химической реакции называется изменение ΔG свободной энергии системы, происходящее при одном пробеге реакции слева направо. Если в исходном состоянии было nн молей начальных компонентов Ан и nк молей конечных компонентов Ак, то свободная энергия Гиббса для системы в исходном состоянии равняется
Поскольку для реакции (4.11) за один пробег слева направо исчезает μн молей компонента Ан и возникает μк молей компонента Ак, то свободная энергия Гиббса в результате такого пробега принимает значение
(4.12)
Тогда общее требование AG = 0 дает искомое условие химического равновесия в виде
Из сравнения формул (4.11) и (4.13) видно, что для записи условия химического равновесия надо химические символы Ан и Ак в уравнении реакции заменить соответствующими химическими потенциалами μн и μк, а на месте стрелок поставить знак равенства. В практике термодинамических расчетов вместо условия химического равновесия в форме (4.13) часто используют так называемый закон действия масс, выведенный в п. 9.1. Правило фаз Гиббса дает число термодинамических степеней свободы, понимаемое как число независимых параметров системы, включая температуру и давление, которые можно продольно менять без нарушения фазового и химического равновесия в системе. Пусть в системе из К компонентов присутствует Ф фаз и протекает Х химических реакций типа (4.11). Равновесное состояние системы в целом характеризуется температурой Т, давлением Р и составом каждой из Ф фаз. Состав одной фазы, держащей к компонентов, однозначно задается их концентрациями, выраженными в мольных долях ишь K - 1 независимых величин, ибо общее число параметров, характеризующих соcтояние системы, равняется 2 + (K - 1)Ф. Эти параметры не являются полностью независимыми, так как на них наложены условия фазового (4.10) и химического (4.13) равновесия, куда входят химические потенциалы μi в свою очередь зависящие от температуры, давления и состава фаз. Число фазовых ограничений равняется числу равенств в выражениях (4.10): в каждой из К строк имеется Ф - 1 независимых равенств, так что общее их число равно (Ф - 1)К. Число химических ограничений типа (4.13) обычно равняется числу Х .химических реакций 1). Таким образом, число термодинамических степеней свободы С равняется числу параметров системы, остающемуся от их общего числа 2 + (К - 1)Ф за вычетом (Ф - 1)К + Х ограничений, вкладываемых условиями фазового и химического равновесия, 1) Строго говоря, величина X может превышать число химических реакций нa число так называемых условий материального баланса, выражающих хранение химических элементов в соответствии со стехиометрией реакции, и условием ввода исходных реагентов в систему. Так, для газофазной реакции 2HCl ↔ H2+Cl2 ввод в систему хлористого водорода порождает в равных количествах Н2 и С12. Тогда условие материального баланса в форме рH2 = рCl2 совместно с условием химического равновесия типа (4.13) (записываемым обычно в форме закона действия масс — см. п. 9.1) дает два химических ограничения (Х= 2). В результате из трех участников реакции независимым остается только один (Кн = К—Х = 1). а именно: С = 2 + К - Ф - X (4.14) Обычно используют число независимых компонентов КН = К — X, вычитая из общего их количества К число X химических ограничений. Тогда правило фаз Гиббса (4.14) принимает распространенную форму записи: С = 2 + КН - Ф (4.15) Число термодинамических степеней свободы возрастает с увеличением независимых компонентов, и уменьшается при увеличении числа фаз в системе. По числу степеней свободы различают нонвариантные (С = 0), моновариантные (С = 1), бивариантные (С = 2) и поливариантные (С > 2) системы. Как видно из формулы (4.15), число равновесных фаз не может превышать числа независимых компонентов в системе больше, чем на два (Ф < 2+Кн). Максимальное число фаз реализуется в нонвариантном системе, когда С = 0. В этом случае все параметры системы строго фиксированы и ни один из них нельзя изменить без нарушения равновесия, что привело бы к исчезновению одной или более фаз. В формулах (4.14) и (4.15) слагаемое 2 учитывает в качестве внешних факторов температуру Т и давление Р. Наиболее часто в технологических процессах полное давление поддерживается равным 1 атм. Тогда правило фаз, записанное в общей форме (4.15), принимает частный вид: С = 1 + Кн- Ф. (4.16) Здесь единица соответствует температуре Т как единственному параметру, используемому в дополнение к составу фаз для управления фазовыми и химическими превращениями в системе. Итак, при равновесии сред, обменивающихся заряженными частицами (электронами или ионами), химические потенциалы этих частиц в контактирующих средах не равны между собой, а различие между ними определяет контактную разность электрических потенциалов. Нетрудно убедиться в том, что для обобщенной химической реакции типа (4.11) участие в ней заряженных частиц сохраняет условие химического равновесия в форме (4.13), но с заменой химических потенциалов μН и μК на соответствующее электрохимические потенциалы
где (φН и φК — электрические потенциалы фаз, в которых находятся начальные (н) и конечные (к) участники химической реакции (4.11). В данном случае условие химического (точнее, электрохимического) равновесия (4.17) необходимо дополнить требованием электронейтральности
Из равенства (4.18) следует, что для химической реакции, все участники которой (как без заряда, так и несущие заряд) находятся в одной и той же фазе с однородным распределением электрического потенциала (φн = φк = φ = const), правая часть выражения (4.17) обращается, в нуль, и оно принимает привычную форму (4.13). Следовательно, любая гомогенная реакция с участием как нейтральных, так и заряженных частиц управляется полученным ранее условием химического равновесия (4.13), включающим обычные химические (а не электрохимические) потенциалы. Это свойство гомогенных реакций будет использовано в п. 11.1: при анализе ионного равновесия в растворах жидких электролитов. Учет электрохимических потенциалов необходим только для гетерогенных реакций, в частности, при рассмотрении электродных процессов в электрохимических системах (см. п. 3.8). В этом случае изобарный потенциал реакции ΔG, определенный в форме (4.12), вместо химических потенциалов μН и μК содержит электрохимические потенциалы ΔG = ΔGхим + ΔGэл, (4.19) где химический вклад в форме (4.12) определяется химическими потенциалами частиц,
а электрический вклад равняется
Следовательно, электрохимическое равновесие, имеющее место, как всегда, при ΔG = 0, осуществляется в результате взаимной компенсации химического и электрического вкладов: ΔGХИМ = ΔGЭЛ, (4.22) что при использовании выражений (4.20) и (4.21) дает ранее полученное равенство (4.17). |
||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 280. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

 . На основании закона сохранения энергии (2.16) записываем дифференциал суммарной энтропии замкнутой системы,
. На основании закона сохранения энергии (2.16) записываем дифференциал суммарной энтропии замкнутой системы,
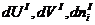 обращение dS в нуль возможно лишь при равенстве нулю сомножителей при этих приращениях. Отсюда получаем искомые условия фазового равновесия для нескольких фаз:
обращение dS в нуль возможно лишь при равенстве нулю сомножителей при этих приращениях. Отсюда получаем искомые условия фазового равновесия для нескольких фаз:
 ,
,

 .
. (4.11)
(4.11) и
и  соответственно, в левой и правой частях реакции) условно названы начальными (н) и конечными (к) участниками данной реакции, несмотря на ее обратимый характер.
соответственно, в левой и правой частях реакции) условно названы начальными (н) и конечными (к) участниками данной реакции, несмотря на ее обратимый характер.

 Отсюда для обобщенной химической реакции (4.11) получаем изобарный потенциал
Отсюда для обобщенной химической реакции (4.11) получаем изобарный потенциал . (4.13)
. (4.13)  , среди которых
, среди которых , i = 1,2,...,K. Следовательно,
, i = 1,2,...,K. Следовательно, и
и  . Запишем модифицированную форму (4.13) в виде
. Запишем модифицированную форму (4.13) в виде , (4.17)
, (4.17) (4.18)
(4.18) и
и  (4.20)
(4.20)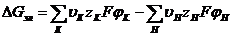 (4.21)
(4.21)