
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Физико-химические условия производстваВосстановление индивидуальных титанатов железа и особенно титановых концентратов представляет собой сложный физико-химический и кристаллохимический процесс[1].Общее представление о его химизме и кинетике можно составить на основе изучения процессов восстановления индивидуальных титанатов, которые являются преобладающей составной частью титановых концентратов (92—97% от общей массы), в частности ильменита. Ильменит — трудновосстановимое и довольно легкоплавкое соединение, которое при температурах восстановительного процесса практически не диссоциирует на FеO и TiO2 и до тройной точки (1273 К) восстанавливается до ТiO2, а после тройной точки — до FeO∙ТiO2. Работами ряда авторов установлено, что при различных условиях закись железа восстанавливается селективно (или происходит одновременное восстановление закиси железа вплоть до металла и ТiO2 до низших оксидов). При этом появление в кристаллической решетке ильменита разновалентных ионов титана создает благоприятные условия для кристаллохимических изменений — образования новых фаз и твердых растворов на основе кристаллических решеток исходных, промежуточных и конечных химических соединений. По мере восстановления содержащейся в ильмените FeO образовавшиеся вакансии в кристаллической решетке ильменита замещаются ионами титана с образованием более богатых по содержанию титана соединений типа FeO∙2TiО2, затем твердых растворов на базе ТiO2 и, наконец, ТiO2. Восстановление входящих в состав титановых концентратов оксидов железа и титана подчиняется разработанной Г. И. Чуфаровым и его сотрудниками сорбционной теории восстановления оксидов металлов твердым углеродом, согласно которой общая схема протекания процесса может быть описана следующими реакциями:  МеО + СО=МеО[СО]+ МеО[CO]+=Me[CO2]+ Me[CO2]++C=Me+C[CO2]+ C[CO2]+=2[CO]+ 2[CO]+=2CO. где [СО]+ и [CО2]+ — поверхностные кетокомплексы на твердом углероде и оксиде металла. Установлено, что лимитирующей скорость восстановления реакцией является распад кетокомплекса С[СО2]+=2[СО]+ При 973—1573 К ильменит может быть восстановлен с помощью СО только при очень высокой концентрации СО в газовой фазе (около 92—95 %). При восстановлении же FeO-TiO2 в указанных условиях образуется газовая фаза, значительно более бедная по СО, что препятствует восстановлению ильменита. При восстановлении ильменита твердым углеродом в результате протекания реакции Будуара содержание СО в сорбционном слое превышает указанные выше пределы (92—95%), что способствует восстановлению FеО∙TiO2. Таким образом, характерной особенностью процесса восстановления ильменита (и других титанатов) твердым углеродом является рост температуры начального шлакообразовании по мере восстановления шихты, что отличает этот процесс от восстановления железных руд, для которого характерно падение температуры начального шлакообразования по мере роста степени восстановления железа. Повышение температуры начального шлакообразования при восстановлении титанатов твердым углеродом создает благоприятные условия для восстановления шихты во всем ее объеме на твердой стадии процесса. FeOж + C=2Fe + CO;
2/3(FeO∙TiO2) + C=2/3Fe +1/3[Ti2O3]FeO∙TiO+ CO;
2(FeO∙TiO2)+C=FeO∙2TiO2+ Fe + CO;
5/6 (FeO∙TiO2) + C=5/6 Fe + 1/10 Ti5O9 + CO;
FeO∙TiO2 + C = Fe + TiO2 + СО;
3/4(FeO∙TiO2)+C=3/4Fe+1/4Ti3O5 + CO;
2/3 (FeO∙TiO2) + C=2/3Fe + l/3Ti2O3 + CO;
l/2(FeO∙TiO2) + C=l/2Fe + l/2TiO + CO;
2/3 [FeO∙TiO2]TiO + C=2/3Fe + 1/3Ti203 +CO;
Восстановление ильменита твердым углеродом протекает следующим образом:
FeO∙TiO2 → FeO∙2TiO2 → TiO2 → Ti5О9 → Ti3О5 → Ti2О3 → TiO. (3.3)
Однако указанный химизм процесса не учитывает важной роли структурного фактора, под влиянием которого может изменяться характер и последовательность указанных реакций. Как отмечалось выше, в окислительно-восстановительных условиях процесса восстановления существуют образуются титанаты и низшие оксиды титана с одинаковой или близкой кристаллической решеткой. Так, FeO∙TiО2, MgO∙TiО2, МпО∙ТiO2, Ti2O3 имеют ромбоэдрическую, FeO∙2TiO2, MnO∙2TiO2, Mg0∙2TiO2 FeО3∙TiО2 и Сг2О3∙ТiO2 — орторомбическую, a MgO∙Ti2O3, 2(Mg. Fe)О∙TiО2, ТiO и TiC — кубическую решетки. Подобие кристаллических решеток может облегчить развитие процессов, протекающих с образованием продуктов, не требующих перестройки кристаллической решетки. Например, этот фактор облегчает восстановление FeO-TiO2 до TiО3, так как при этом не возникает фаза с иной кристаллической решеткой, на образование которой необходимо затратить дополнительную энергию. Наоборот, из-за образования новой кристаллической решетки при восстановлении ильменита, входящего в состав твердого раствора на основе Ti2O3, востановление FeO затрудняется. Таким образом, вследствие фактора подобия кристаллических решеток имеет место иная, чем указано выше, последовательность процесса восстановления
[Ti2O3]FeO∙TiO→[FeO∙TiO2]TiO→Ti2O3→TiO (3.4) Fe∙TiO2
[TiO2]FeO∙2TiO→TiO2→Ti5O9→Ti3O5→TiO2 (3.5) т. е. уже на первых этапах восстановления благодаря благоприятному структурному фактору возможно образование низших оксидов титана и твердых растворов на их основе и, следовательно, совместное присутствие FeO и низших оксидов титана при высокой температуре в восстановительной среде. При восстановлении ильменита на стадии, расплава интенсивно протекает процесс восстановления ТiO2 до Ti2O3 с преимущественным образованием тагировита. Минералогический анализ шлака свидетельствует о том, что в этих условиях восстановление содержащегося в ильмените FeO затруднено и заметное развитие получает восстановление TiО2 до низших оксидов. Это приводит к обогащению расплава оксида двухвалентного железа и сосуществованию его вместе с низшими оксидами титан на (фаза 2FеO∙TiО2). Затем 2FеO∙TiО2 восстанавливается до FеO∙ТiO2 и FeO∙2TiO2, что приводит к увеличению продолжительности процесса, расхода восстановителя и электроэнергии. Из изложенного выше следует, что восстановление ильменита в расплаве протекает в более трудных условиях, усугубляющихся расслоением расплава и твердого восстановителя, а также вскипанием высокоэлектропроводного расплава. Это приводит к отключению печи и к нестабильной ее работе, что особенно затрудняет процесс плавки с ростом мощности электропечного агрегата. Таким образом, при восстановлении ильменита на стадии расплава образуются в основном твердые растворы ряда тагировита, требующие для восстановления содержащейся в них FeO и стабилизации шлаков с минимальным содержанием железа дополнительных затрат времени, электроэнергии и восстановителя. На основе изложенного сделан вывод о целесообразности создания условий для преимущественного восстановления ильменита па твердой стадии процесса, т. е. до образования шлакового расплава.
|
||
|
Последнее изменение этой страницы: 2018-04-11; просмотров: 399. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
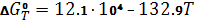 ;
;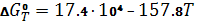 ;
;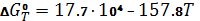 ;
;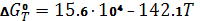 ;
;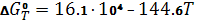 ;
;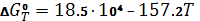 ;
;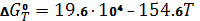 ;
;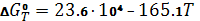 ;
;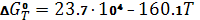 ;
;