Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Влияние антидепрессантов на нейротоксическое действие синтетического глюкокортикоида дексаметазона в разных структурах головного мозга.Стр 1 из 4Следующая ⇒ У большинства больных различными формами депрессии выявляются нарушения деятельности гипоталамо - гипофизарно - надпочечниковой системы, что проявляется увеличением концентрации гидрокортизона в плазме крови и снижением величин показателей дексаметазонового суппрессивного теста [125; 126]. При повышении уровня глюкокортикоидов в крови и в мозге, обусловленное хроническим стрессом или введением эндогенных кортикостероидов, наблюдается уменьшение количества пирамидных нейронов в области СА3 гиппокампа у крыс [127; 128]. В исследованиях in vitro выявлено токсическое действие глюкокортикоидов на культивируемые нейроны мозга грызунов [45]. Установлено также, что различные глюкокортикоиды обладают определенным регионально специфическим действием. Так, неселективный агонист глюко- и минералокортикоидных рецепторов кортикостерон (основной кортикостероид грызунов) вызывает повреждение пирамидных нейронов области СА3 гиппокампа [46], в то время как селективный агонист глюкокортикоидных рецепторов дексаметазон при системном введении вызывает преимущественное повреждение зернистых клеток зубчатой извилины [48]. Однако в исследованиях, выполненных с использованием более тонких методов, установлено, что системное введение дексаметазона крысам вызывало дозозависимую активацию микроглии (маркер апоптоза нейронов), увеличение количества нейронов с морфологическими признаками апоптоза и уменьшение иммунореактивности к МАР-2 (белку микротрубочек цитоскелета нейронов) в дорсомедиальных отделах стриатума, в зубчатой извилине и в областях СА1 и СА3 гиппокампа, но не в латеральном септальном ядре; указанные морфологические изменения предупреждались конкурентным блокатором глюкокортикоидных рецепторов мифепристоном[52]. Можно думать, что наблюдаемое при разных формах депрессии уменьшение объёма гиппокампа и стриатума, выявленные в посмертных препаратах мозга больных [128; 129], хотя бы частично связаны с нарушением деятельности гипоталамо- гипофизарно- надпочечниковой системы и повышением концентрации глюкокортикоидов в плазме крови и мозге.  В то же время, остаётся не ясным соответствуют ли наблюдаемые морфологические изменения в исследуемых структурах мозга, вызываемые воздействием глюкокортикоидов, изменениям их функционального состояния с учетом компенсационных возможностей нейронов. Кроме того, остаётся не выясненной природа повреждающего структуру нейронов действия глюкокортикоидов. В настоящем разделе предпринята попытка выяснить характер вызываемых селективным агонистом глюкокортикоидных рецепторов дексаметазоном функциональных изменений в нейронных популяциях зубчатой извилины, области СА1 гиппокампа, дорсального стриатума и теменной коры и их нейротоксическую природу. О функциональных нарушениях нейронов исследуемых структур мозга, вызываемых дексаметазоном, судили по изменениям эффективности глутаматергичской синаптической передачи в указанных образованиях мозга. Такой методический прием оправдан тем, что традиционные методы определения повреждения нейронов достаточно инертны и их результаты становятся доступными через сутки, в то время как используемый нами метод определения повреждения нейронов дает значимые результаты уже через 1 час (смотри материалы и методы).
1.1. Влияние исследуемых антидепрессантов на эффекты дексаметазона в исследованиях на пирамидных нейронах области СА1 гиппокампа. Объект исследования синаптическая передача между аксонами пирамидных нейронов области СА3 (коллатерали Шаффера) и дендритами нейронов области СА1, а также синаптическая реактивность, как отношение амплитуды пВПСП к интенсивности стимуляции коллатералей Шаффера.
Рис. 1.1. Зависимость величин постсинаптических ответов пирамидных нейронов области СА1 от интенсивности пресинаптической стимуляции. Фокальные потенциалы, генерируемые исследуемыми нейронами (А), и зависимость их амплитуды от интенсивности пресинаптической стимуляции (Б). В верхней части рисунка (А) представлены осциллограммы популяционных ВПСП, вызываемые стимуляцией коллатералей Шаффера при увеличении ее интенсивности в диапазоне 5 - 25 В в одном из срезов гиппокампа. Каждый ВПСП усреднен по 10 реализациям. Калибровка: 1 мВ, 10 мс. В нижней части рисунка (Б) представлены графики зависимости амплитуд ВПСП от интенсивности пресинаптической стимуляции у интактных крыс. По вертикальной шкале - амплитуда популяционных ВПСП в мВ, по горизонтальной - интенсивность пресинаптической стимуляции в В. Как следует из рисунка 1.1 зависимость амплитуд пВПСП пирамидных нейронов области СА1 гиппокампа от интенсивности пресинаптической стимуляции коллатералей Шафера носит практически линейный характер. Если учесть, что сопротивление раздражающего нихромового электрода ≈0.2 мОм, а передаточное число изолирующего трансформатора 1.5, то параметры стимуляции волокон коллатералей Шафера составляет 75-200 мкА, что соответствует синаптической реактивности пирамидных нейронов области СА1, полученной другими исследователями. При расчете синаптической реактивности мы не использовали величины амплитуд пВПСП, получаемых при стимуляции коллатералей Шафера меньше 10 В и более 25 В, поскольку в этих областях кривая зависимости амплитуд пВПСП от интенсивности пресинаптической стимуляции имела перегибы. Для исследования влияния селективного агониста глюкокортикоидных рецепторов дексаметазона на синаптическую реактивность пирамидных нейронов области СА1 мы воспользовались данными литературы. В исследованиях Heynes и соавторов (2001) было установлено, что дозы внутрибрюшинно вводимого крысам линии Wistar дексаметазона, которые вызывали наибольшие морфологические повреждения нейронов, составляет 7 и 20 мг/кг . Через 24 часа после в/б введения крысам дексаметазона в дозе 7 мг/кг амплитуда пВПСП пирамидных нейронов области СА1 гиппокампа, вызываемых стимуляцией коллатералей Шаффера претерпела существенные изменения в сравнении с постсинаптическими ответами в контроле при той же интенсивности пресинаптической стимуляции.
Рис. 1.2. Зависимость амплитуд популяционных ВПСП пирамидных нейронов области СА1 от интенсивности пресинаптической стимуляции интактных и подвергнутых воздействию дексаметазона в дозе 7мг/кг крыс. В верхней части рисунка (А) представлены осциллограммы популяционных ВПСП контрольных крыс (К) и крыс, которым вводили дексаметазон в дозе 7 мг/ кг (7). Калибровка: 1 мВ, 10 мс. В нижней части рисунка (Б) представлены графики зависимости амплитуд ВПСП от интенсивности пресинаптической стимуляции у контрольных (К) и подвергнутых воздействию дексаметазона крыс (7). По вертикальной шкале - амплитуда популяционных ВПСП в мВ, по горизонтальной - интенсивность пресинаптической стимуляции. Выявлено уменьшение амплитуды пВПСП пирамидных нейронов области СА1. Кроме того, кривая, характеризующая зависимость величин постсинаптических ответов от интенсивности пресинаптической стимуляции стала более пологой и плоской (рис.1.2). Если учесть, что фундаментальное свойство любого проекционного нейрона, к числу которых относятся пирамидные нейроны области СА1, это способность генерировать постсинаптический потенциал при активации выделяющимся из пресинаптических бутонов медиатором постсинаптических рецепторов в дендритных шипиках, то наблюдаемое снижение амплитуды пВПСП пирамидных нейронов является критерием ухудшения функционального состояния, т.е. повреждения пирамидных нейронов
К – контроль; 20 – через 24 часа после введения дексаметазона в дозе 20 мг/кг. В верхней части рисунка (А) представлены осциллограммы популяционных ВПСП контрольных крыс (К) и крыс, которым вводили дексаметазон в дозе 20 мг/ кг (20). Калибровка: 1 мВ, 10 мс. В нижней части рисунка (Б) представлены графики зависимости амплитуд ВПСП от интенсивности пресинаптической стимуляции у контрольных (К) и подвергнутых воздействию дексаметазона крыс (20). По вертикальной шкале - амплитуда популяционных ВПСП в мВ, по горизонтальной - интенсивность пресинаптической стимуляции в В.
Еще более жесткое ухудшение функционального состояния пирамидных нейронов области СА1 наблюдаются через 24 часа после ведения крысам дексаметазона в дозе 20 мг/кг (рис.1.3). В этом случае практически отсутствуют постсинаптические ответы при интенсивности стимуляции коллатералей Шафера 10 и 15 В. Амплитуда же наблюдаемых ответов пирамидных нейронов у крыс, которым вводили дексаметазон в дозе 20 мг\кг, в 4-5 раз меньше амплитуды постсинаптических ответов пирамидных нейронов у контрольных крыс. Вызываемое токсическими дозами дексаметазона ухудшение функционального состояния нейронов, проявляющееся снижением амплитуд пВПСП пирамидных нейронов (рис.1.2 и 1.3), может быть следствием повреждения процессов пресинаптического высвобождения глутамата, либо постсинаптического аппарата дендритных шипиков. Общепринятым экспресс методом идентификации пре- или постсинаптического локуса повреждения является исследование изменений величины парного облегчения при нанесении на пресинаптические волокна двух импульсов с интервалом 40-100 мс. Если наблюдаемое при этом парное облегчение, т.е. увеличение амплитуды второго пВПСП по отношению к первому, уменьшается, то это указывает на пресинаптический локус; если же величина парного облегчения не изменяется, то это свидетельствует об изменениях в постсинаптическом аппарате дендритных шипиков []. В таблице 1.1 приведены величины парного облегчения пВПСП. Таблица 1.1. Величины парного облегчения в % пВПСП пирамидных нейронов области СА1 в срезах гиппокампа контрольных и подвергнутых воздействию декаметазона в дозах 7 и 20 мг/кг.
Поскольку достоверные отличия величин парного облегчения отсутствуют, можно думать о повреждении дексаметазоном постсинаптического аппарата дендритных шипиков. В то же время, при воздействии дексаметазона в дозе 20 мг/кг наблюдается недостоверная тенденция к снижению величины парного облегчения и расширению доверительного интервала (табл. 1.1). Вероятно при воздействии данной дозы глюкокортикоида имеют место начальные повреждения и пресинаптического аппарата. В дальнейшем эффекты дексаметазона можно охарактеризовать по изменению синаптической реактивности, которая определяется отношением амплитуд постсинаптических ответов в мВ к интенсивности стимуляции коллатералей Шаффера в В. Вызываемые используемыми дозами дексаметазона изменения синаптической реактивности представлены в следующем рисунке.
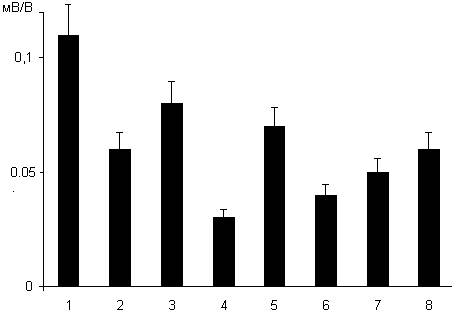
Рис. 1.4. Изменения синаптической реактивности пирамидных нейронов области СА1, вызываемые используемыми дозами дексаметазона. 1- контроль; 2 и 3 – через 24 часа после введения дексаметазона в дозах 7 и 20 мг/кг соответственно. По вертикальной шкале – синаптическая реактивность в мВ/В. Вертикальные линии у столбцов – доверительный интервал при р = 0.05. Из рисунка 1.4 видно, что синаптическая реактивность пирамидных нейронов области СА1 изменяется параллельно сдвигу кривых зависимости величин пВПСП от интенсивности пресинаптической стимуляции (рис. 1.2 и 1.3). Природа нейронповреждающего действия глюкокортикоидов окончательно не выяснена. Имеются данные, что оно частично может быть связано с усилением глутаматергического эксайтотоксического механизма [52]. Для уточнения механизмов нейронповреждающего действия дексаметазона мы провели нейрохимический анализ. Исследовали влияние веществ – анализаторов на вызываемое дексаметазоном, используемым в дозе 7 мг/кг, угнетение синаптической реактивности пирамидных нейронов области СА1.
Рис. 1.5. Влияние веществ-анализаторов на вызываемое дексаметазоном (7 мг/кг) угнетение синаптической реактивности пирамидных нейронов области СА1. 1 – контроль; 2 – через 24 часа после введения 7 мг/кг дексаметазона; 3 – 8 – то же в условиях введения крысам кетамина 50 мг/кг (3), глицина 50 мг/кг (4), натрия ортованадата 15 мг/кг (5), имипрамина 20 мг/кг (6), флуоксетина 20 мг/кг (7) и пиразидола 20 мг/кг (8).
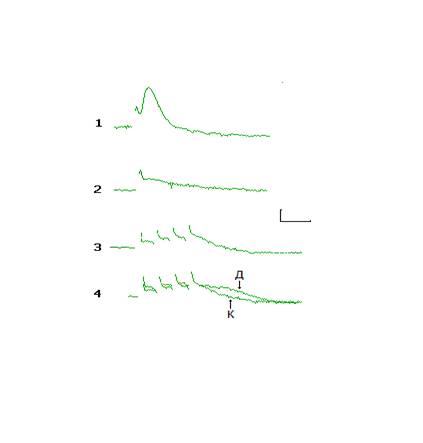
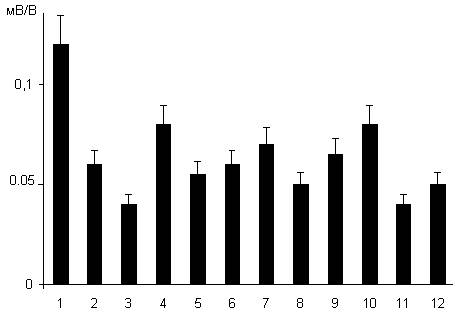
Вызываемое воздействием дексаметазона, водимого крысам в дозе 7 мг/кг, угнетение синаптической реактивности пирамидных нейронов области СА1 гиппокампа ослаблялось введением экспериментальным животным неселективного неконкурентного блокатора НМДА глутаматных рецепторов кетамина в дозе 50 мг/кг (рис. 1.5, столбец 3). Напротив, введение ко-агониста нейрональных НМДА рецепторов глицина в дозе 50 мг/кг вызывало усиление нейрон-повреждающего действия глицина (рис. 1.5, столбец 4), которое в этом случае достигало уровня повреждения пирамидных нейронов области СА1, вызываемого введением дексаметазона в дозе 20 мг/кг (ср. рис. 1.4 и 1.5). Какова роль глутаматергической нейропередачи НМДА глутаматных рецепторов в нейротоксическом действии глюкокортикоидов окончательно не понятна. Для решения этой проблемы проведена специальная серия исследований на зернистых нейронах зубчатой извилины. Результаты этой серии представлены в рис.1.5а. Одиночная стимуляция волокон префронтального пути вызывает пВПСП зернистых нейронов (1). При суперфузии срезов гиппокампа раствором Кребса со сниженной до 0.2 мМ концентрацией Mg2+ , и блокадой с помощью DNQX и пикротоксина соответственно AMPA и ГАМК А рецепторов, та же стимуляция сопровождается генерацией НМДА-компонента пВПСП (2). При нанесении на волокна префронтального пути серийного раздражения из 4-х импульсов с частотой 100 Гц, возникает ответ, который обусловлен активацией синаптических НМДА рецепторов и вследствие накопления в синапсах глутамата и «перелива» его за пределы синапса и внесинаптических НМДА рецепторов (3). Скорость спада этого ответа определяется активностью нейрональных и глиальных транслоказ глутамата. Обработка срезов гиппокампа дексаметазоном (100 нМ) в течение 30 минут и последующей экспозицией в нормальном растворе Кребса в течение 2-х часов, приводит к усилению ответов нейронов, вызываемых активацией синаптических и внесинаптических НМДА рецепторов, и, самое главное, увеличивает продолжительность ответа, вызываемого серийным раздражением [4, осциллограммы К (контроль) и д (после дексаметазона)]. Результаты этих исследований показывают, что дексаметазон угнетает процессы синаптического клиренса глутамата и повышает концентрацию медиатора в синапсах и внесинаптических пространствах. Подобно блокатору НМДА рецепторов кетамину вводимый в дозе 15 мг/кг натрия ортованадат (рис. 1.5, столбец 5), который не является блокатором нейрональных НМДА рецепторов, но угнетает активность тирозиновых фосфопротеинфосфатаз, ослаблял нейронповреждающее действие дексаметазона. При однократном введении крысам в дозе 20 мг/кг относящихся к разным функциональным классам антидепрессантов были получены следующие результаты. Неселективный ингибитор обратного захвата норадреналина и серотонина имипрамин подобно глицину усиливал нейрон-повреждающее действие дексаметазона в дозе 7 мг/кг (рис. 1.5, столбец 6). Подобный эффект, но выраженный в несколько меньшей степени обнаруживал селективный ингибитор обратного захвата серотонина флуоксетин (рис. 1.5, столбец 7). Наконец, однократно вводимый относящийся к классу селективных ингибиторов моноаминоксидазы типа А пиразидол не оказывал влияния на вызываемое дексаметазоном в дозе 7 мг/кг угнетение синаптической реактивности пирамидных нейронов области СА1 (рис. 1.5, столбец 8). Совершенно иное влияние оказывали исследуемые антидепрессанты в условиях их хронического введения по сравнению с их однократным введением. Как следует из рисунка 1.6 имипрамин, флуоксетин и пиразидол ослабляют вызываемое дексаметазоном в дозе 7 мг/кг угнетение синаптической реактивности пирамидных нейронов области СА1 (рис. 1.6, столбцы 2,4,7 и 10). Точно так же хронически вводимые антидепрессанты противодействуют нейрон-повреждающему действию используемого в дозе 20 мг/кг дексаметазона (рис. 1.6, столбцы 3,5,8 и 11). Действие хронически вводимых имипрамина, флуоксетина и пиразидола формально сходно с влиянием на эффекты дексаметазона ингибитора тирозиновых фосфопротеинфосфатаз натрия ортованадата (рис. 1.5 и 1.6). В то же время при совместном введении исследуемых антидепрессантов и натрия ортованадата выявлено усиление протективного действия антидепрессантов, проявляющееся ослаблением вызываемого дексаметазоном (20 мг/кг) угнетения синаптической реактивности пирамидных нейронов области СА1, по сравнению с эффектами только хронически вводимых антидепрессантов (рис. 1.6, столбцы 5 и 6, 8 и 9, 11 и 12).
Рис 1.5а. Влияние дексаметазона (100 нМ) на ответы зернистых нейронов зубчатой извилины, вызываемые серийной стимуляцией волокон префронтального пути. Пояснения в тексте. Калибровка: по вертикали 0.5 мВ (1) и 0.25 мВ (2-4); по горизонтали 20 мс.
Рис. 1.6. Влияние хронического введения исследуемых антидепрессантов на вызываемое дексаметазоном угнетение синаптической реактивности пирамидных нейронов области СА1. 1 – контроль; 2 и 3 – через 24 часа после введения дексаметазона в дозах 7 и 20 мг/кг соответственно; 4,7 и 10 – эффекты дексаметазона (7 мг/кг) после хронического введения имипрамина, флуоксетина и пиразидола; 5, 8 и 11 – эффекты дексаметазона (20 мг/кг) после хронического введения имипрамина, флуоксетина и пиразидола; 6, 9 и 12 – то же, что и на 5, 8 и 11 на фоне предварительного введения 15 мг/кг натрия ортованадата.
|
||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 169. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
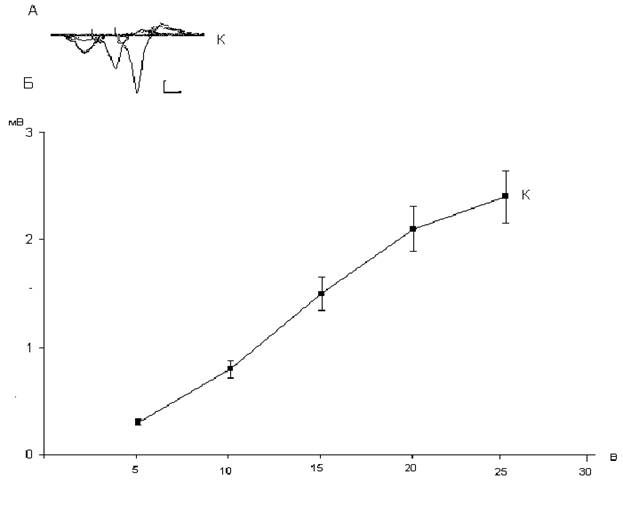
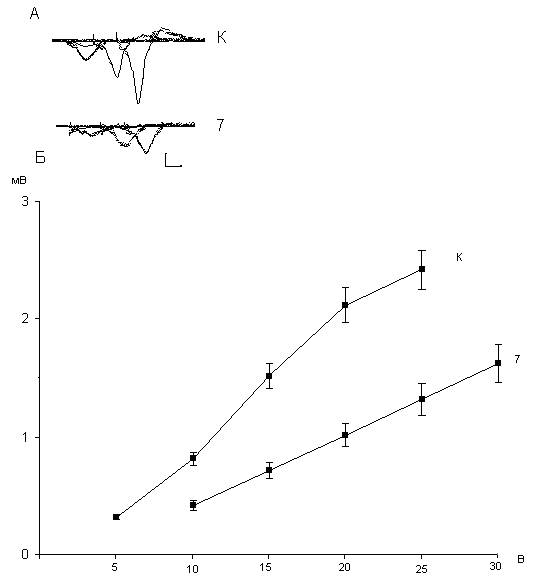
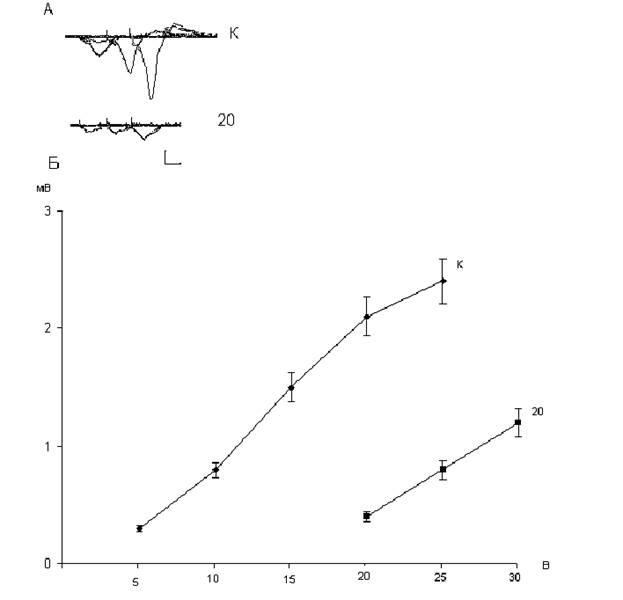 Рис. 1.3. Зависимость амплитуд популяционных ВПСП пирамидных нейронов области СА1 от интенсивности пресинаптической стимуляции интактных и подвергнутых воздействию дексаметазона в дозе 20 мг\кг.
Рис. 1.3. Зависимость амплитуд популяционных ВПСП пирамидных нейронов области СА1 от интенсивности пресинаптической стимуляции интактных и подвергнутых воздействию дексаметазона в дозе 20 мг\кг.