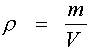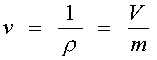Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Основные понятия и законы термодинамикиСтр 1 из 12Следующая ⇒ Содержание 1. Агрегатные состояния вещества………………………………………………………..3 2. Твердые тела и их свойства……………………………………………………………..4 3. Объединенный газовый закон…………………………………………………………..5 4. Основные понятия и законы термодинамики………………………………………….6 5. Смачивание капиллярные явления…………………………………………………….11 6. Коллоидные системы…………………………………………………………………...13 7. Поверхностные явления………………………………………………………………..15 8. Растворы. Как происходит растворение. Насыщенные растворы…………………..17 9. Кинетика химических процессов……………………………………………………...23 10. Свойства переноса в многокомпонентных системах………………………………...28 11. Кинетика гетерогенных процессов……………………………………………………30 12. Многокомпонентные системы………………………………………………………....31 13. Структурно-геометрические характеристики пористых сред……………………….33 Список использованной литературы……………………………………………………..37 Агрегатные состояния вещества Все вещества могут существовать в трех агрегатных состояниях - твердом, жидком и газообразном. Четвертым агрегатным состоянием вещества часто считают плазму. Переходы между ними сопровождаются скачкообразным изменением ряда физических свойств (плотности, теплопроводности и др.). Агрегатное состояние зависит от физических условий, в которых находится вещество. Существование у вещества нескольких агрегатных состояний обусловлено различиями в тепловом движении его молекул (атомов) и в их взаимодействии при разных условиях. Газ - агрегатное состояние вещества, в котором частицы не связаны или весьма слабо связаны силами взаимодействия; кинетическая энергия теплового движения его частиц (молекул, атомов) значительно превосходит потенциальную энергию взаимодействий между ними, поэтому частицы движутся почти свободно, целиком заполняя сосуд, в котором находятся, и принимают его форму. Любое вещество можно перевести в газообразное, изменяя давление и температуру.  Жидкость - агрегатное состояние вещества, промежуточное между твердым и газообразным. Для нее характерна большая подвижность частиц и малое свободное пространство между ними. Это приводит к тому, что жидкости сохраняют свой объем и принимают форму сосуда. В то же время жидкость обладает рядом только ей присущих свойств, одно из которых - текучесть. В жидкости молекулы размещаются очень близко друг к другу. Поэтому плотность жидкости гораздо больше плотности газов (при нормальном давлении). Свойства жидкости по всем направлениям одинаковы (изотропны) за исключением жидких кристаллов. При нагревании или уменьшении плотности свойства жидкости, теплопроводность, вязкость меняются, как правило, в сторону сближения со свойствами газов. Тепловое движение молекул жидкости состоит из сочетания коллективных колебательных движений и происходящих время от времени скачков молекул из одних положений равновесия в другие. При наличии внешней силы, сохраняющей свое направление более длительное время, чем интервалы между скачками, молекулы перемещаются в направлении этой силы, что и приводит к текучести жидкости. Твердые тела - агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов. Это движение вызывает колебания атомов (или ионов), из которых состоит твердое тело. Амплитуда колебаний обычно мала по сравнению с межатомными расстояниями. Полиморфизм - способность некоторых веществ существовать в состояниях с различной атомно-кристаллической структурой (сера, кремнезем имеют более чем две полиморфные модификации). Одиночные кристаллы называют монокристаллами. У монокристаллов некоторые свойства анизотропны, т. е. зависят от направления (механические, оптические и электрические). Естественная анизотропия - характерная особенность кристаллов; например, пластинка слюды легко расщепляется на тонкие листочки вдоль определенной плоскости (параллельно этой плоскости силы сцепления между частицами слюды наименьшие). Твердое тело, состоящее из большого числа маленьких кристаллов, называют поликристаллическим. Поликристаллические материалы изотропны. Плазма - частично или полностью ионизированный газ, в котором плотности отрицательных и положительных зарядов одинаковы. При сильном нагревании любое вещество испаряется, превращается в газ. Если увеличивать температуру и далее, резко усиливается процесс термической ионизации. Молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы. В состоянии плазмы находится подавляющая часть вещества Вселенной: звезды, галактические туманности и межзвездная среда. Около Земли плазма существует в виде солнечного ветра и ионосферы. На поверхности Земли в естественных условиях плазма - редкий гость, появляющийся лишь при вспышках молний. В лабораторных условиях плазма впервые появилась в виде газового разряда. Она заполняет лампы дневного света, стеклянные трубки неоновой рекламы и т. д. За последние годы применение плазмы существенно расширилось. Высокотемпературная плазма (Т ~ 106-108К) из смеси дейтерия с тритием используется для осуществления управляемого термоядерного синтеза; низкотемпературная плазма (Т =< 105 К) - в различных газоразрядных приборах: газовых лазерах, ионных приборах, МГД-генераторах и так далее. Твердые тела и их свойства Твердое вещество используется человеком с давних пор. Это основной материал, из которого создаются орудия труда и различные приспособления, использующиеся в нашей жизни. На заре человеческой истории человек мог использовать лишь механические свойства этих тел. В наши дни используются также электрические, магнитные, тепловые и другие свойства твердого вещества. Благодаря широкому использованию твердых тел человечество накопило большой эмпирический материал об их свойствах, который лег с основу теории твердого тела, созданной в классической науке. Твердые вещества – это тела, отличающиеся постоянством формы и объема. Твердые тела могут существовать в двух состояниях – кристаллическом и аморфном. Кристаллы характеризуются так называемым дальним порядком расположения атомов, который выражается в строгой повторяемости во всех направлениях одного и того же структурного элемента на протяжении сотен и тысяч периодов кристаллической решетки. Кристаллическое состояние является устойчивым состоянием всех твердых тел. Существуют монокристаллы – тела, имеющие форму правильных многогранников. Но большинство твердых тел являются поликристаллами, имеющими мелкокристаллическую структуру и состоящими из большого числа сросшихся, мелких, хаотично расположенных кристаллических зерен. В аморфных телах дальний порядок отсутствует, поэтому аморфные тела можно рассматривать как жидкости с очень большой вязкостью. В аморфном состоянии могут находиться обычное стекло, сера, глицерин, а также многие полимеры, состоящие из большого числа повторяющихся групп атомов. Аморфные вещества при определенных условиях переходят в твердое состояние. Свойства: 1.Твердые тела обладают механическими свойствами, которые проявляются в ответ на внешние механические воздействия– сжатие, растяжение, изгиб, удар и т.д. В зависимости от внутреннего строения, наличия дефектов, специфики обработки твердые тела могут быть хрупкими или пластичными. 2.С точки зрения электрических свойств все твердые тела делятся на металлы, полупроводники и диэлектрики. 3.По магнитным свойствам выделяют диамагнетики (вода, соль, золото), парамагнетики (алюминий, литий, калий), ферромагнетики (железо) и антиферромагнетики (некоторые редкоземельные элементы). 4.При повышении температуры твердые тела увеличивают свои линейные размеры и объем – это так называемое тепловое расширение твердых тел. Сильное нагревание может привести к переходу вещества в жидкую (плавление) или газообразную (сублимация, возгонка) фазу. 5.Твердые тела способны деформироваться при изменении температуры или внешнем силовом воздействии. После прекращения воздействия деформация может исчезнуть (упругая деформация) или остаться (остаточная деформация). Объединенный газовый закон Объединяя законы Бойля - Мариотта и Гей-Люссака , можно получить следующее уравнение:
Которое является математическим выражением объединенного газового закона, или закона состояния газов. Он позволяет вычислить, например, объем газа при определенных температуре и давлении, если известен его объем при других значениях температуры и давления. Объединенный газовый закон можно также записать в другой форме:
Точное значение постоянной в правой части этого уравнения зависит от количества газа. Если количество газа равно одному молю (см. гл. 4), то соответствующая постоянная обозначается буквой R и называется молярная газовая постоянная, или просто газовая постоянная. Если давление выражено в атмосферах, постоянная R имеет значение R = 8,314 Дж*К* моль-1 Объединенный газовый закон для одного моля газа приобретает вид
где Vm- объем одного моля газа. Для п молей газа получается уравнение
В такой форме объединенный газовый закон называется уравнением состояния идеального газа. Уравнение состояния это уравнение, связывающее между собой параметры состояния газа-давление, объем и температуру. Газ, который полностью подчиняется уравнению состояния идеального газа, называется идеальный газ. Такой газ не существует в действительности. Реальные газы хорошо подчиняются уравнению состояния идеального газа при низких давлениях и высоких температурах. Отклонения в поведении реальных газов от предписываемых уравнением состояния идеального газа подробно обсуждаются ниже. Вычисление относительной молекулярной массы с помощью уравнения состояние идеального газа. Уравнение состояния идеального газа позволяет проводить прямые вычисления относительной молекулярной массы газа M1. Введем понятие относительной молекулярной массы, основываясь на уже знакомом нам определении относительной атомной массы A1. Для газа, состоящего из простых молекул, относительная молекулярная масса представляет собой сумму относительных атомных масс всех атомов, входящих в молекулу. Например, для диоксида углерода
Относительная молекулярная масса, выраженная в граммах на моль, называется молярной массой .Следовательно, молярная масса CO2 равна 44 г/моль. Два моля CO2 имеют массу 88 г, а и молей-массу п -44 г. В общем случае можно записать
где n-количество вещества в молях (т.е. число молей данного вещества), т-масса вещества в граммах, a M-его молярная масса. Подстановка полученного выражения для получения в уравнение состояния идеального газа (4) дает
Это уравнение позволяет, зная массу и объем газа при определенных температуре и давлении, вычислить его молярную массу М. А поскольку M = M (г/моль), то полученный результат непосредственно дает относительную молекулярную массу М. Основные понятия и законы термодинамики Термодинамика – один из важнейших разделов физики и физической химии, предметом изучения которого являются: а) основные соотношения, позволяющие рассчитать количество выделенного или поглощенного тепла в физических и химических превращениях и совершаемую при этом работу; б)выявление возможного самопроизвольного течения процессов в определенном направлении, их равновесие. Термодинамика – наука о закономерностях превращения энергии. В термодинамике широко используется понятие термодинамической системы. Термодинамической системой называется совокупность материальных тел, взаимодействующих, как между собой, так и с окружающей средой. Поскольку одно и тоже тело, одно и тоже вещество при разных условиях может находится в разных состояниях, (пример: лед – вода – пар , одно вещество при разной температуре) вводятся, для удобства, характеристики состояния вещества – так называемые параметры состояния. Перечислим основные параметры состояния вещества: Температура тел - определяет направление возможного самопроизвольного перехода тепла между телами. Соотношение для перехода от градусов Цельсия к градусам Кельвина: T [K] = t [°C] + 273. где: T - температура в Кельвинах, t – температура в градусах Цельсия. Давление - представляет собой силу, действующею по нормали к поверхности тела и отнесенную к единице площади этой поверхности. Для измерения давления применяются различные единицы измерения. В стандартной системе измерения СИ единицей служит Паскаль (Па). Соотношение между единицами: 1 бар = 105 Па 1 кг/см2 (атмосфера) = 9.8067×104 Па 1мм рт. ст (миллиметр ртутного столба) = 133 Па 1 мм вод. ст. (миллиметр водного столба) = 9.8067 Па Плотность– отношение массы вещества к объему занимаемому эти веществом.
Удельный объем - величина обратная плотности т.е. отношения объема занятого веществом к его массе.
|
||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 178. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 (3)
(3)

 (4)
(4)

 (5)
(5)