
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
При электролизе раствора соли
Выберите правильный вариант. 91.Из смеси катионов: Ag+, Cu2+, Fe2+, Zn2+ в первую очередь восстановятся катионы:
92.Для покрытия металла никелем электролиз ведут, используя:
93.При электролизе раствора хлорида натрия среда раствора у катода: 1) кислая 2) нейтральная 3) щелочная 94. Кальций можно получить из хлорида кальция путем: 1) электролиза раствора 2) электролиза расплава 3) восстановлением водорода 4) термического разложения. 95. При электролизе раствора хлорида меди ( анод медный ) на аноде окислится: 1) хлор 2) кислород 3) водород 4) медь 96.При электролизе раствора карбоната натрия с графитовыми электродами на аноде происходит: 1) выделение СО2 2) выделение кислорода 3) выделение водорода 4) осаждение натрия. Часть В Дайте полное решение заданий. Составьте электронную формулу атомов железа, графически укажите валентные электроны в нормальном и возбужденном состояниях. Какие степени окисления может проявлять атом железа? Приведите примеры оксидов и гидроксидов железа в соответствующих степенях окисления, укажите их характер. 2. Если в момент химического равновесия 2NO + O2 1) 12 моль/л и 8 моль/л; 2) 14 моль/л и 8 моль/л; 3) 16 моль/л и 12 моль/л;  4)32 моль/л и 24 моль/л. 3. Окисление аммиака протекает по уравнению: кДж/моль г г г ж (-285,84) теплота образования аммиака ( 1) -92,15 кДж/моль; 2) 92,15 кДж/моль; 3) 46,76 кДж/моль; 4)-46,76 кДж/моль. Реакция восстановления оксида меди (II) алюминием возможна
КДж/моль -129,8 -1582 свободная энергия Гиббса ( 1) -1192 кДж; 2) -3576 кДж; 3) +1192 кДж; 4)+3576 кДж . 5. При взаимодействии 1 моль ортофосфорной кислоты с 1 моль гидроксидом натрия образуется: 1) ортофосфат натрия 3) дигидроортофосфат натрия 2) гидроортофосфат натрия 4) фосфат натрия Составьте молекулярно-ионные уравнения реакций. Сумма всех коэффициентов в кратком ионном уравнении равна… 6. Метилоранж становится желтым при растворении в воде каждой из двух солей: 1) K2S и K3PO4 3) LiCl и FeSO4 2) KNO3 и K3PO4 4) CH3COOK и K2SO4 Составьте молекулярно-ионные уравнения реакций гидролиза. 7. При взаимодействии водных растворов солей сульфата алюминия и карбоната натрия, сумма коэффициентов в кратком ионном уравнении равна: 1) 10 2) 12 3) 13 4) 9 8. Кислая среда образуется при растворении в воде каждой из двух солей: 1) BaCl2 и AlCl3 3) CuCl2 и LiCl 2) K2S и K3PO4 4) NH4NO3 и Zn(NO3)2 Составьте молекулярно-ионные уравнения гидролиза, выведите константу гидролиза по первой ступени. 9. В уравнение реакции схема которой:
Сумма коэффициентов перед формулами исходных веществ равна: 1) 20 3) 25 2) 18 4) 22 Дайте полное решение задания (используйте ионно-электронный метод). 10. Установите правильную последовательность действий при определении типа гибридизации Ц.А. в частице: 1. Определите тип гибридизации; 2. Вычислите ст. ок., Ц.А. и число неспаренных ( 3. Найдите Ц.А. в частице; 4. Укажите К.Ч. (Ц.А.) и число 5. Графически изобразите валентные ( 6. Определите валентные электроны, участвующие в образовании связей в периферийных атомах и покажите их перекрывание с ГАО Ц.А. 7. Изобразите структурную формулу, указывающую геометрию частицы. Установите соответствие: 11. Тип гибридизации Ц.А. Частица 1) sp2 a) Н2О 2) sp3 б) ВН3 3) sp3d в) SCl6 4) sp3d2 г) CO 5) sp д) PCl5 Рассмотрите по алгоритму те частицы, в которых Ц.А. в sp3 и sp3d гибридизации. 12. В Г.Э.: Ag | AgNO3 | | Fe(NO3)2 | Fe
Рассчитайте ЭДС при н.у. |
||||||||||
|
Последнее изменение этой страницы: 2018-05-31; просмотров: 258. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
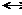 2NO2 концентрации NO, O2 и NO2 соответственно равны 8 моль/л., 6 моль/л., 4 моль/л., то начальные концентрации исходных веществ (NO и O2) были:
2NO2 концентрации NO, O2 и NO2 соответственно равны 8 моль/л., 6 моль/л., 4 моль/л., то начальные концентрации исходных веществ (NO и O2) были: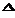 Н обр. 4NH3 + 3O2 = 2N2 + 6 H2O
Н обр. 4NH3 + 3O2 = 2N2 + 6 H2O  FeSO4 + KMnO4 + H2SO4 Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
FeSO4 + KMnO4 + H2SO4 Fe2(SO4)3 + MnSO4 + K2SO4 + H2O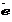 );
);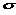 связей;
связей;