Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Диссоциация электролиты
При диссоциации электролитов образуется число ионов Электролиты число ионов 1. KAl(SO4)2 в) 4 иона 2. Fe2(SO4)3 г) 5 ионов 3. CrBr3 в) 4 иона 4. AlCl3 в) 4 иона лишние ответы б) 2 иона а) 3 иона д) 6 ионов
Среда раствора рН 1. нейтральная б) рН = 7 2. кислая а) рН = 4 3. щелочная в) рН = 9 г) рН = 11
Установление правильную последовательность действий 39. При составлении ионных уравнений реакций необходимо: 1. записать схему реакции 2. определить силу электролита 3. расписать сильные электролиты на ионы 4. уравнять атомы 5. сократить одинаковые ионы 6. 7. 1, 4, 7, 2, 3, 5, 6 Выберите правильный вариант
1. 2. 3. 4.
Соответствует сокращенное ионное уравнение
С уменьшением концентрации соли степень диссоциации 1) возрастает 3) не изменится 2) уменьшается 
Дополните: В результате гидролиза соли образуется электролит слабый 44. Гидролиз соли протекает по катиону, если соль образована слабым основанием, сильной кислотой и рН = меньше 7 (кислая) Гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой Выберите правильный ответ: 46. Полному гидролизу подвергается: 1) AlCl3 3)KCl 2) ZnCl2 4) Al2S3 47. Гидролизу не подвергается: 1) Na2CO3 3) Na3PO4 2) NaBr 4) Na2SiO3
Дополните: 48.Степень окисления –это условная величина, с помощью которой принято описывать окислительно-восстановительные реакции. Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд. Окисление – процесс отдачи электронов Если алгебраическая величина (С.О.) уменьшается, то протекает процесс восстановления Восстановитель в ходе окислительно-восстановительной реакции отдает электроны Сложное вещество, содержащее элемент в высшей степени окисления играет роль окислителя Ме – простые вещества являются восстановителями 54.Чем меньше величина 55. ЭДС рассчитывают по формуле ЭДС=φ катода — φ анода( ЭДС=φ окислителя — φ восстановителя); ЭДС > 0, то реакция возможна Установите соответствие: Окислительно-восстановительная реакция Тип
Б 2-в 3- г 4- а Выберите правильный вариант: 57.В кислой среде (С.О.) марганца в KMnO4 изменяется до: 1) Mn0 3) Mn+4 2) Mn+2 4) Mn+6 58.Вещество проявляет только окислительные свойства: 1) Сr2(SO4)3 3) СrSO4 2) Сr0 4) K2Сr2O7 59.Окислительно-восстановительную двойственность проявляет: 1) H2SO4 3) Na2SO4 2) Na2SO3 4) H2S Дополните: 60.Анод – электрод, на котором протекает процесс окисления 61.На границе Металл – раствор возникает электростатическое притяжение прилегающий слой жидкости заряжается положительно 62.Полуэлементом называют электрод, погруженный в подходящий электролит, разработанный для измерения электродного потенциала. 63.Стандартный (нормальный) электродный потенциал металла – это это потенциал металла, определенный относительно стандартного (нормального) водородного электрода, при условии, что концентрация ионов водорода Н+ и ионов испытуемого металла Men+ равны 1 моль-ион/л при стандартных условиях (298К, 101кП) 64.В цинковом полуэлементе – условно-графическая схема, которого
Zn2+ | Zn0 (2+ и 0 это заряды, наверху пишите) процесс возникновения электродного потенциала отражает x уравнение Zn-2e = Zn 2+ (2+ это заряд напишите сверху) 65.Если возрастает концентрация ионов металла в растворе, то электродный потенциал уменьшается 66.Уравнение Нернста при Т = 298 К имеет вид ….
67.j катода больше j анода. Установите соответствие: 68.В Г.Э.: Sn | SnSO4 | | NiSO4 | Ni
68. В Г. Э.: Сu | CuCl2 | | ZnCl2| Zn
Выберите правильный вариант: 69. Если в гальвоническом элементе Анод – железный электрод, тогда Катод в Г.Э.:
Составьте условно- графическую схему. Sn | SnCl2 | | FeCl2| Fe
70.pH =5, j p H2/н+ равно:
Ответ 3 Дополните: 71.Электрохимическая коррозия – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока. 72.На анодных участках протекает процесс называемый окислением а с электронной точки зрения – это процесс отдачи электронов 73.Деполяризаторы – вещества, которые служат для поглощения водорода, выделяющегося на положительном электроде гальванического элемента к ним относятся: 1) Деполяризаторы первого типа 2) Деполяризаторы второго типа 74. В кислой среде на катоде протекают два процесса – химизм: 1) а) в нейтральных или щелочных средах - 2Н2О + О2+ 4е- = 4ОН-
2) в кислых средах - О20+ 4Н+ = 2Н2О
75.Электрохимическая коррозия возможна, если электродный потенциал анодного процесса меньше электродного потенциала катода Установите соответствие: 76. Виды коррозии: Примеры:
77. Для защиты металла от коррозии применяют способы: Примеры:
78. Вид коррозионных процессов: При контакте фаз:
Алюминий склёпан медью
Выберите правильный вариант ответа. 80.Покрытие анодное: 1) цинк – медью; 2) медь – алюминием; 3) медь – золото; 4) алюминий – серебром. 81.При нарушения покрытия во влажном воздухе химизм процесса на электродах
Анод Fe → Fe2+ + 2e Происходит реакция окисления. Катод На катоде проходит реакция восстановления. O2 + 2H2O + 4e → 4OH- (кислородная деполяризация в нейтральных, щелочных средах) O2 + 4H+ + 4e → 2H2O (кислородная деполяризация в кислых средах) 2 H+ + 2e → H2 (при водородной деполяризации). Дополните: 82.Устройство для электролиза называется электролизер, в нем энергия электрическая, превращается в энергию химическую 83.Анод – электрод, на котором идет процесс окисления, имеет заряд положительный, подходят частицы отрицательные (анионы) 84.На катоде в первую очередь разряжаются частицы, j р которых имеет большее значение (более положителен) 85.Сила тока (Ja), необходимая для электролиза вычисляется по формуле … Закон Фарадея: m = (M*I*t)/(n*F) M - молекулярная масса металла, г/моль I - сила тока, А t - время, с n - кол-во электронов, участвующих в процессе F - число Фарадея, равно 96500 Кл. Выражаем силу тока: I = (m*n*F)/(M*t)
86.На аноде разряжается кислотный остаток безкислородный 87.Электрод – «окислитель» это катод 88.Электролиз с растворимым анодом используется: 1) в гальванотехнике для покрытия одних металлов тонким слоем других 2) рафинирование (очищение) металлов
Установите соответствие:
Б, 2- в, 3- а |
||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-31; просмотров: 255. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

 2. в одну ступень ( ) г) ZnCl2
2. в одну ступень ( ) г) ZnCl2  3. ступенчато ( первичная ) д) Na[Al(OH)4]
3. ступенчато ( первичная ) д) Na[Al(OH)4] 
 ( вторичная )
( вторичная )  записать кратное ионное уравнение
записать кратное ионное уравнение в виде молекул записать ( (осадки); (газы); слаб.эл-ты)
в виде молекул записать ( (осадки); (газы); слаб.эл-ты) 40. Краткое ионное уравнение имеет вид: 2H+ + CO2-3 CO2 + H2O при взаимодействии:
40. Краткое ионное уравнение имеет вид: 2H+ + CO2-3 CO2 + H2O при взаимодействии: Li2CO3 + H2SiO3
Li2CO3 + H2SiO3 CaCO3 + H2SO4
CaCO3 + H2SO4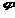 о, тем сильнее выражены свойства окислителя
о, тем сильнее выражены свойства окислителя 1) 2KNO3 2KNO2 + O2 a) сопропорционирования
1) 2KNO3 2KNO2 + O2 a) сопропорционирования 4) 2Na2S + Na2SO3 + 3H2SO4 3S + 3Na2SO4 + 3H2O г) межмолекулярная
4) 2Na2S + Na2SO3 + 3H2SO4 3S + 3Na2SO4 + 3H2O г) межмолекулярная