
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Тема 1.7. Металлы и неметаллы ⇐ ПредыдущаяСтр 9 из 9 Металлы – это химические элементы, атомы которых отдают электроны внешнего (некоторые – и предвнешнего) электронного слоя, превращаясь в положительные ионы – катионы. Фрагмент ряда активности металлов: Li K Ba Ca Na Mg Al Mn Zn Cr Fe Co Sn Pb H Cu Hg Ag Au. Металлы, стоящие в ряду активности до водорода, вытесняют его из растворов многих кислот, а все следующие за ним - не вытесняют. Исключение составляют концентрированная серная и азотная кислоты, которые реагируют с большинством металлов, но водорода при этом никогда не выделяется. В металлургии железо и его сплавы выделяют в одну группу под названием черные металлы, а все остальные металлы имеют техническое название - цветные. Сталь – это сплав на основе железа, содержащий менее 2 % углерода. По химическому составу стали разделяют на углеродистую и легированную. Чугун – это сплав на основе железа, содержащий от 2 до 4,5 % углерода, а также марганец, кремний, фосфор и серу. Металлы легко отдают валентные электроны, т.е. обладают восстановительными свойствами. Восстановительная способность – мера химической активности металлов.
Химические свойства металлов: Металлы реагируют с простыми веществами. 1) С галогенами (элементы VII группы). Пример: 2Na+J2 ® 2NaJ – йодид натрия. 2) С элементами VI группы. Пример: 2Mg+O2 ® 2MgO – оксид магния; Ca+S ® CaS – сульфид кальция. 3) С элементами V группы. Пример: 3Ca+2P ® 3Ca+N2 ® 3 4) С элементами IV группы. Пример: Са+2С ® СаС2 – карбид кальция. 5) Щелочные и щелочно-земельные металлы реагируют с водородом. Пример: 2Na+H2 Металлы реагируют со сложными веществами.  1) Металлы вытесняют водород из разбавленных кислот (кроме HNO3): Ba+2HCl ® BaCl2 + H2; разб. Fe + H2SO4 ® FeSO4 + H2; разб.
2) С водой (с образованием гидроксидов и оксидов): 2Na+2H2O ® 2NaOH+H2 (при обычной температуре только щелочные и щелочно-земельные металлы); Zn+H2O 3) С растворами солей: Fe+CuSO4 ® FeSО4+Cu¯; Zn+Pb(NO3)2 ® Pb¯+Zn(NO3)2. Неметаллы – это химические элементы для атомов, которых характерна способность принимать электроны до завершения внешнего энергетического уровня, так как на внешнем электронном слое от 4 до 8 ē, малый радиус атомов в сравнении с атомами металлов. Всего известно 22 неметалла (в том числе инертные газы). Исключение: элементы 8 группы главной группы – инертные газы. Они относятся к неметаллам только по физическим свойствам. Их инертность относительна: 1 2 3 4 5 6 7 8 группа
3 Si P S Cl Ar
4 As Se Br Kr
5 Te J Xe
6 At Rn Все неметаллы являются p-элементами, кроме водорода и гелия. Н, Не – S-элементы. Неметаллы – это химические элементы, которые образуют в свободном состоянии простые вещества, не обладающие физическими и химическими свойствам металлов. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества - неметаллы в отличие от металлов плохо проводят тепло и электричество, не обладают пластичностью. Они имеют атомное и молекулярное строение, представленное схемой:
Неметаллы (простые вещества) |
||||||
|
Последнее изменение этой страницы: 2018-05-31; просмотров: 215. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
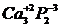 - фосфид кальция;
- фосфид кальция; - нитрид кальция.
- нитрид кальция. 2NaH – гидрид натрия.
2NaH – гидрид натрия. Cu+HCl ®
Cu+HCl ® ZnO+ H2.
ZnO+ H2. ,
,  . Неметаллы обладают высокими значениями электроотрицательности (ЭО). Положение неметаллов в Периодической системе химических элементов (ПСХЭ) можно изобразить следующим образом:
. Неметаллы обладают высокими значениями электроотрицательности (ЭО). Положение неметаллов в Периодической системе химических элементов (ПСХЭ) можно изобразить следующим образом: 1 Н Не
1 Н Не
 2 В С N O F Ne
2 В С N O F Ne