
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Тема 1.5. Классификация неорганических соединений и их свойстваОксиды – это сложные вещества, состоящие из атомов кислорода и какого-нибудь другого химического элемента. Оксиды образуют все химические элементы, кроме He, Ne, Ar. Разнообразие оксидов представлено следующей схемой:
Для составления названия оксида нужно: 1) указать слово «оксид», а затем в родительном падеже название второго элемента: Na2О– оксид натрия; 2) если химический элемент может образовать несколько оксидов, то после названия элементов в скобках указывают его валентность: FeO – оксид железа (II), Fe2O3 – оксид железа (III). При написании формул оксидов кислород всегда ставят на второе место, кроме OF2. Основания – это сложные вещества, которые состоят из атомов металла и одной или нескольких гидроксогрупп Ме(ОН)Х. В названиях оснований в начале указывают слово «гидроксид», а затем название металла, и если металл имеет переменную валентность, то в скобках указывают его валентность: CuOH – гидроксид меди (I), Cu(ОН)2 – гидроксид меди (II). Щелочи - растворимые в воде основания (NaOH). Кислоты – это сложные вещества, содержащие в своем составе водород, способный замещаться металлом и образовать соли. Формулы наиболее распространённых кислот и названия их солей приведены в таблице 1.5.1. 1) Название бескислородной кислоты состоит из названия неметалла с добавлением буквы «-о-» и слова «водородная». Например: H2S – сероводородная кислота. 2) Название кислородосодержащей кислоты зависит от валентности элемента, образующего кислоту: если кислота содержит элемент с высшей валентностью, но название состоит из названия этого элемента и окончания « -ная» или «-вая». Например:  3) Название кислоты, которая содержит элемент с меньшей валентностью, имеет окончание « -истая».
Таблица 1.5.1
Продолжение таблицы 1.5.1
Соли – сложные вещества, продукт полного или частичного замещения атомов водорода в молекуле кислот на металл или же продукт полного или частичного замещения гидроксогруппы в основании на кислотный остаток. Классификация солей выражается следующим образом:
Названия солей зависят от принадлежности их к данным группам, обусловлены названием кислотного остатка. 1) Названия солей бескислородных кислот и соединений металлов с неметаллами производятся от корня слова латинского названия неметалла с добавлением суффикса «-ид», а далее – название металла. Например: CaS – сульфид кальция. 2) К названиям солей металлов, имеющих переменную валентность, добавляют число, обозначающее валентность. Например: Fe2(SO4)3 – сульфат железа (III) 3) В названия кислых солей добавляют приставку «гидро-», а если соль содержит два незамещенных атома водорода - «дигидро-». Например: КНСО3 – гидрокарбонат калия, КН2РО4 – дигидрофосфат. 4) Названия основных солей начинаются с приставки «гидрокси-». Например: Mg(OH)Cl – гидроксихлорид магния. Соли бывают двойными и смешанными. Двойные соли – соли, состоящие из различных катионов и общего кислотного остатка (KAl(SO4)2, NaNH4CO3). Смешанные соли – соли, состоящие из общего металла и разных кислотных остатков. Например: CuCH3COONO3 – нитрат-ацетат меди (II). СаCl2+K2CO3 → CaCO3↓+2KCl Pb(NO3)2+2KOH = Pb(OH)2↓+2KNO3 CaCO3+2HCl=CaCl2+H2O+CO2↑ CaCO3 CaCO3+SiO2
Гидролиз солей – это реакция обмена ионов соли с ионами воды. 1) гидролизу подвергаются только растворимые в воде соли, 2) гидролиз приводит к образованию слабого электролита, 3) реакция гидролиза подчиняется принципу Ле Шателье (при повышении температуры, увеличении количества Н2О гидролиз усиливается), 4) гидролиз протекает ступенчато, 5) соли, образованные сильным основанием и кислотой, гидролизу не подвергаются, 6) наиболее полному гидролизу подвергаются соли, образованные слабой кислотой и основанием, 7) гидролиз является обратимым процессом.
1. Пример гидролиза соли, образованной сильным основанием и сильной кислотой
HCl – сильная кислота KCl « K++ Cl-
H2O « OH- + H+ Гидролиз не идет, рН = 7,среда нейтральная.
2. Пример гидролиза соли, образованной сильным основанием и слабой кислотой:
HNO2 – слабая кислота KNO2 « K++
КNO2 + H2O « KOH + HNO2
Гидролиз этой соли идет по аниону, рН >7, СН+<СОН-, среда щелочная.
3. Пример гидролиза соли, образованной слабым основанием и сильной кислотой.
HCl – сильная кислота CuCl2 « Cu2++ 2Cl‑
I ступень CuCl2 + H2O « CuОНCl + HCl
Cu2+ + HOH « CuOH + Н+ Гидролиз данной соли идет по катиону, ступенчато, так как катион меди – многозарядный, СН+ > СОН-, рН<7, среда кислая. Ионное произведение воды – произведение концентраций ионов водорода Н и гидроксид – ионов в воде. Пример: Н2О « Н++ОН- КВ = [Н+][ОН-]=10-14, при t=25°С.
Задания для самоконтроля: Задание № 1.Укажите, какие из солей, формулы которых AgCl, Al2(SO4)3, CaCO3, BaSO4, K2S, K2SO4, способны подвергаться гидролизу. Напишите уравнения гидролиза в ионной форме. Укажите реакцию среды (кислая, щелочная, нейтральная) растворов этих солей. Задание № 2. Назовите следующие вещества: K2O, MgCO3, NaOH, K2SO4, FeCl2, Al2(SO4)3, KHS, Mn2O7, H2CO3, Fe(OH)3, Na2SiO3, H2SO4, NaNO3. Задание № 3. Напишите формулы следующих соединений: а) гидроксид алюминия, б) перманганат калия, в) гидроксид хрома (III), г) соляная кислота, д) циановодородная кислота, е) фосфат кальция. Задание № 4. Напишите уравнения реакций, с помощью которых можно осуществить превращения: Na → NaOH → Na2CO3 → Na2SO4 ↓ NaHCO3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-31; просмотров: 193. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

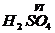 – серная кислота.
– серная кислота. - сернистая кислота.
- сернистая кислота.



 Соли
Соли продукт полного замещения водорода в кислоте металлом
2KOH+H2CO3®
K2CO3+2H2O
карбонат
калия
продукт полного замещения водорода в кислоте металлом
2KOH+H2CO3®
K2CO3+2H2O
карбонат
калия
 продукт неполного замещения водорода в кислоте металлом
NaOH+H2CO3®
NaHCO3+H2O
гидро-
карбонат
натрия
продукт неполного замещения водорода в кислоте металлом
NaOH+H2CO3®
NaHCO3+H2O
гидро-
карбонат
натрия
 CaO+CO2
CaO+CO2 KCl КОН – сильное основание
KCl КОН – сильное основание Н2О « Н+ + ОН-
Н2О « Н+ + ОН-


 K+ + Cl- + H+ OH- « K+ + OH- + H+ + Cl-
K+ + Cl- + H+ OH- « K+ + OH- + H+ + Cl- KNO2 КОН – сильное основание
KNO2 КОН – сильное основание

 CuCl2 Cu(OH)2– слабое основание
CuCl2 Cu(OH)2– слабое основание
 Cu2+ + 2Cl- + HOH « CuОН+ + Cl- + Н+ + Cl-‑
Cu2+ + 2Cl- + HOH « CuОН+ + Cl- + Н+ + Cl-‑