
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Определение состава газовой смеси ⇐ ПредыдущаяСтр 2 из 2 Анализ пожарной опасности производственных объектов предусматривает оценку пожарной опасности технологических сред, которая состоит в определении комплекса показателей, перечень которых зависит от агрегатного состояния реагентов, а также их соотношения в смеси. Для этих целей используют расчеты по определению возможного состава газовых смесей. В практических расчётах состав многокомпонентной смеси можно выражать в долях или процентах. Различают массовые (ω), молярные (χ) и объёмные доли (φ):
где ωi – массовая доля i-го компонента; mi – масса i-го компонента;
где хi – молярная доля i-го компонента; νi – количество вещества i-го компонента; Пересчёт массового состава в молярный и обратный пересчёт осуществляют по формулам:
где Мi – молярная масса i-го компонента.
где Vi –объём i-го компонента; ΣVi – сумма объёмов n компонентов. Для газовых смесей состав, выраженный объёмными и молярными долями, одинаков. Например: определить объемные и молярные составы газовой смеси (этилен, пропилен), подаваемой в реактор на полимеризацию, если плотность подаваемой газовой смеси по воздуху равна 1,4. Предположим, что молярная доля этилена χ(С2Н4)= х Тогда, молярная доля пропилена χ(С3Н6)= 1-х Рассчитываем молярные массы компонентов газовой смеси, молярную массу заданной газовой среды: М(С2Н4)= 2 М(С3Н6)= 3 М(смеси)=D(смеси по воздуху) М(смеси)=1,4 Составляем уравнение: 28х + (1-х) 42=40,6 28х+42 – 42х = 40,6 -14х = -1,4  х=0,1 Тогда молярная доля этилена: χ(С2Н4)= 0,1 а, молярная доля пропилена: χ(С3Н6)= 1-х= 1- 0,1=0,9 Поскольку молярные и объемные доли в газовой смеси совпадают (следствие из закона Авогадро) то, объемные доли компонентов газовой смеси соответственно составят: φ(С2Н4)= 10%; φ(С3Н6)= 90% Многие реальные газы при определенных условиях (в условиях промышленного синтеза) близки к идеальным.
Расчет концентрации газа и пара при выходе из аппаратов, работающих под избыточным давлением Масса паров, выделяющихся в производственное помещение из открываемых на загрузку продуктов герметичных аппаратов (при отсутствии воздухообмена в помещении ), определяется по формуле Расчет концентрации паров ЛВЖ и ГЖ при выходе из аппаратов, периодически открывающихся для загрузки веществ Объем зоны взрывоопасных концентраций, VВОК:, м3, определяем по формуле: Образование горючей среды при аварийном режиме А) Определить массу жидкости, испарившейся с поверхности разлива: Б) Интенсивность испарения рассчитывается по формуле: В) Плотность паров жидкости рассчитываем по формуле: Г) Средняя концентрация паров в помещении при аварийной ситуации: Д) Расчет размера зоны образовавшегося горючего облака, при аварийном поступлении горючих газов и паров жидкостей в промышленное помещение Е) Расчет избыточного давления ∆Р для горючих газов, паров легковоспламеняющихся и горючих жидкостей. 1.Расчет избыточного давления ∆Р для индивидуальных горючих веществ, рассчитывается по формуле 2. Расчет избыточного давления ∆Р для горючих смесей, рассчитывается по формуле:
Расчет избыточного давления для пылевоздушных смесей
|
||
|
Последнее изменение этой страницы: 2018-05-30; просмотров: 241. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 ,
,
 – сумма масс n компонентов смеси.
– сумма масс n компонентов смеси.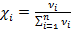 ,
, – сумма количеств веществ n компонентов смеси.
– сумма количеств веществ n компонентов смеси.
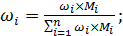
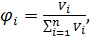
 12 + 4
12 + 4  29 =40,6 (г/моль)
29 =40,6 (г/моль)